6. PKC osalusel kulgev signaali tee.
Mitmete neurotransmitterite retseptorite stimuleerimisel aktiveeritakse proteiinkinaas C (PKC). See signaali tee algab metabotroopselt retseptorilt, mis on seotud G-valguga, Gq. See G-valk aktiveerib fosfolipaasid, need hüdrolüüsivad membraani fosfolipiide.
6.1. Fosfolipaasid.
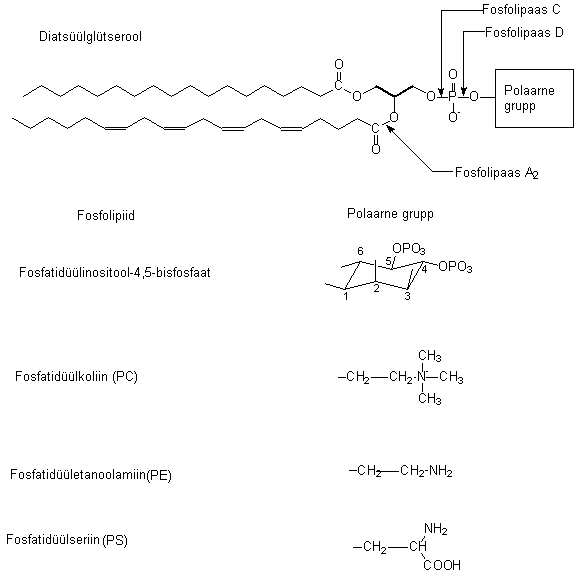
Fosfolipaasid hüdrolüüsivad membraanide fosfolipiide. Pildil 22 on toodud fosfolipiidi ehitus ja lipaaside atakeerimise kohad. Vastavalt sellele, millist sidet fosfolipaas lõhub, on jagatud nad rühmadesse: fosfolipaas C, D ja A. Peale selle jagatakse neid substraadi järgi: fosfatidüül-inositooli, fosfatidüülkoliini või teisi hüdrolüüsiv ensüüm.
Pilt 22. Fosfolipiidid ja nende lõhkumine fosfolipaasidega.
Fosfolipiidid koosnevad kahest rasvhappe jäägist (näiteks, arahhidoonhape, steariinhape), glütseroolist, fosfaadist ja polaarsest rühmast. Enamlevinud fosfolipiidide polaarsed rühmad on pildil: inositool-4,5-bisfosfaat, koliin, etanoolamiin, seriin. Olulisemaid fosfolipiide signaali ülekandes on fosfatidüül-inositool-4,5-bisfosfaat, PtdIns(4,5)P2. Seda lõhuvad kolme tüüpi fosfolipaasid:
1) Fosfolipaas C (PLC) annab produktidena diatsüülglütserooli (DAG) ja inositool-1,4,5-trisfosfaadi (IP3).
2) Fosfolipaas D (PLD) annab fosfatidüülhappe (PA) ja inositool-4,5-bisfosfaadi.
3) Fosfolipaas A2 (PLA2) annab arahhidoonhappe (AA) ja lüsofosfatidüülinositooli.
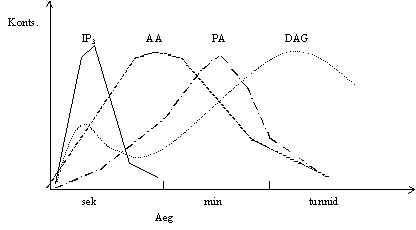
Retseptori stimuleerimisel aktiveeritakse kõiki neid fosfolipaase. Sagali nimetataksegi neid signaal-aktiveeritud fosfolipaasideks ja kasutatakse lühendit SAP. Pildil 23 on fosfolipaaside aktivatsiooni jälgitud.
Pilt 23. Fosfolipaaside aktivatsiooni hindamine.
Peale retseptori stimuleerimist mõõdetakse rakus fosfolipiidide lagunemisel tekkivaid ühendeid. Kiiresti tekib IP3 kontsentratsiooni tõus ja sellega kaasneb ka DAG teke, järelikult on aktiveerunud PLC, seda sekundite jooksul. Ka AA tõus algab kohe, kuid on kestvam (sekundid ja minutid), järelikult on aktiivne ka PLA2. Fosfatidüülhappe tõus algab veidi hiljem ja kestab kauem, aktiivne on PLD. Aktiveerub nii fosfatidüül-ionsitooli PLC kui ka fosfatidüülkoliini PLC. Esineb veel teine DAG tõus, see võib olla tekkinud fosfatidüülhappest fosfataasi toimel, kuna sel ajal on juba PA tase rakus piisavalt kõrge.
DAG tõusu on leitud väga mitmete retseptorite stimuleerimisel, sealhulgas ka kasvufaktorite retseptorite aktivatsioonil. DAG metaboliseerub rakkudes kiiresti. DAG tõusu on leitud ka tuumas, DAG ei toodeta mitte ainult ja mitte alati plasmamembraanist, vaid ka tuumamembraanidest.
Fosfolipaasidest uurituim on PLC perekond, sisaldab 16 isoensüümi, jagatakse kolme rühma (b, g, d). On PtdInsPLC ja PtdC-PLC, s.t. kasutavad substraadina fosfatidüülinositooli või fosfatidüülkoliini. PtdInsPLC isosüümid näitavad kindlat erinevust oma katalüütilistes omadustes, rakuspetsiifilises ekspressioonis ja aktiveerimise viisis. PLCb ja PLCg on paremini uuritud, esimene neist seostub G-valkudega ja teine fosfotürosiiniga. Ka need PLC alarühmad sisaldavad mitut ensüümi, mis on erinevalt reguleeritavad. Näiteks on teada, et PLCb1 aktiveeritakse G-valgu a-subühikuga, ja PLCb2 aktiveeritakse G-valgu bg-subühikuga. PLC kõik alarühmad sisaldavad peale katalüütilise ala pleksitriini homaloogiat (PH ala), mis seob inositoollipiide, ja C2 ala, mis seob paljudes valkudes rasvhappeid ja Ca-ioone. PLCb alarühma valgud omavad G-valkudega sidumise kohta. PLCg ensüümid aga sisaldavad SH2 alasid, mis lubavad neil fosfotürosiiniga siduda.
PLD katalüüsib peale fosfolipiidi hüdrolüüsi ka trans-fosfatidüleerimist, s.t. vahetab ära polaarseid rühmi fosfolipiidis, eelistab substraadina Ptd-koliini. PLD produktist fosfatidüülhappest võib saada ka DAG, fosfataasi toimel. PLD perekonnas on ka mitmeid isovorme, kuid neid on veel vähe iseloomustatud. PLD aktiivsus on leitud enamuse kudede plasmamembraanis ja rakusisestes membraanides. Üks kopsust puhastatud PLD (M 190000) on akiveeritav Ca ja Mg-ioonidega ja mitteküllastunud rasvhapetega. Teine ajust saadud PLD (M 95000) on aktiveeritav PtdIns(4,5)P2 poolt. Mõned vormid on hoopis inhibeeritavad PtdIns(4,5)P2-ga. PLD aktiivsus on stimuleeritud nii G-valkudega seotud retseptorite kui ka türosiinkinaassete retseptorite kaudu. PLD on aktiveeritav ka PKC poolt, kuid see ei toimu fosforüleerimise teel, vaid PKC regulaator-piirkonna kaudu. Mehhanism pole teada.
PLA2 perekond sisaldab ka mitmeid isovorme. On iseloomustatud suur hulk sekreteeritavaid ja tsütosoolseid vorme. Sekreteeritavad on madala molekumassiga (M 13-18 kDa), paljud vajavad aktiveerimiseks Ca-ioone mM kontsentratsioonis. Ca-sõltumatud vormid on leitud nii sekreteeritavate kui tsütoplasmaatiliste vormide hulgast. Tsütoplasmaatilised on suurema molekumassiga (M 29 ja 85 kDa). PLA2 aktiivsust reguleeritakse nii transkriptsiooniliselt kui posttranskriptsiooniliselt mRNA eluea muutmise kaudu. Valgu aktiivsust suurendab tema fosforüleerimine PKC või MAP kinaasi poolt. Membraaniga seostumine aktiveerib ensüümi ja ensüümi aktiveerimist soodustab Ca2+; PLA2 valgu N-otsas on Ca-ga reguleerimise ala, see on oluline membraaniga sidumisel. PLA2 aktiveerivad ka muutused membraanis, mõned väikesed hüdrofoobsed peptiidid võivad ensüümi aktiveerida. PLA2 aktiveerub paljude retseptorite stimuleerimisel, seda nii G-valkudega seotud kui türosiinkinaassete retseptorite puhul.
Signaali ülekandes on oluline, et fosfolipaasid toodavad DAG, cis-küllastumata rasvhappeid (näiteks arahhidoonhape) ja PI3, mis on signaali vahendajaiks sellel teel.
6.2.Proteiinkinaas C (PKC).
Proteiinkinaas C on perekond ensüüme, mis fosforüleerivad valgus seriini ja treoniini, s.t. on seriin/treoniin-proteiin-kinaasid. PKC on vähem spetsiifiline kui PKA, ei vaja kindlat aminohappelist järjestust, arginiini rikas valk seostub substraadi sidumise kohaga ja selles fosforüleeritakse Ser või Thr. Arginiini rikkad peptiidid võivad käivitada PKC autokatalüütilise aktiivsuse. PKC on aktiveeritav fosforüleerimisega C-terminaalses alas (Thr 500), ta võib ise ennast fosforüleerida Ser 660 kohalt. Klassikalised PKC aktivaatorid on DAG, cis-küllastamata rasvhapped ja Ca2+. Kui DAG-ga aktiveerimisel lisada cis-küllastamata rasvhappeid, siis Ca vajadus langeb ja ensüüm on aktiivne väga madalatel Ca-iooni kontsentratsioonidel. PKC aktivatsiooni võimendajateks on sellised happed nagu oleiinhape, linoolhape, linoleenhape, arahhidoonhape jt., ei võimenda küllastunud rasvhapped ja trans-küllastumata rasvhapped.
PKC on teada 10 struktuurselt lähedast isovormi. Tabelis 3 on nende iseloomustus.
Tabel 3. PKC isovormid.
Alaliik am.h. M(kDa) Aktivaatorid Kude, kus ekspresseerub Grupp A, klassikalised PKC (cPKC) a 672 76,8 PS, Ca, DAG, FFA, LysoPC igal pool b I 671 76,8 PS, Ca, DAG, FFA, LysoPC mõnedes kudedes b II 673 76,9 PS, Ca, DAG, FFA, LysoPC paljudes kudedes g 697 78,4 PS, Ca, DAG, FFA, LysoPC ajus Grupp B, uued PKC (nPKC) d 673 77,5 PS, DAG igal pool e 737 83,5 PS, DAG, FFA ajus jm. h (L) 683 77,9 ? kopsus, nahas, südames q 707 81,6 ? skeleti lihastes Grupp C, ebatüüpilised PKC (aPKC) z 592 67,7 PS,FFA igal pool l 586 67,2 ? munasarjas, testises
Tabelis 3 on PKC aminohapete arv, molekulkaalud on 76-90 kDa. Jagatakse kolme gruppi: A- klassikalised PKC,( a, bI, bII, g ), cPKC; B - uued PKC, (d, e,h,q ), nPKC; C - ebatüüpilised PKC, (z, l ), aPKC. Klassikalised PKC on aktiveeritavad fostatidüül-seriini (PS), DAG, cis-küllastumata rasvhapete (FFA), lüsofosfatidüül-koliini (LysoPC) ja Ca2+ poolt. Uued PKC ei vaja aktivatsiooniks Ca-ioone, on aktiveeritavad DAG, fosfatidüülseriiniga ja cis-küllastumata rasvhapete poolt. Ebatüüpilised PKC ei vaja ei Ca-ioone ega DAG, küll aga on aktivaatoriteks cis-küllastamata rasvhapped ja PS.
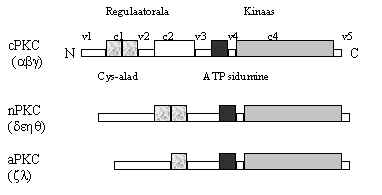
Pildil 24 on võrreldud nende PKC erinevate vomide ehitust. Uued ja ebatüüpilised PKC vormid on oma valgust mitmeid osasid kaotanud.
Pilt 24. PKC isovormide erinevused.
Kõik PKC vormid omavad homoloogset katalüütilist piirkonda ja erinevusi regulaator-alas. PKC molekul koosneb viiest variaabel-osast ( v1-v5) ja neljast konserveerunud osast (c1-c4). N-otsas on regulaator-ala, mis koosneb mitmest spetsiifilisest domäänist: v1 - inhibiitor piirkond, pseudo-substraadi järjestus, mis võib okupeerida substraadi sidumise koha katalüütilises tsentris ja muudab sellega ensüümi inaktiivseks. c1 - koosneb kahest tsüsteiini-rikkast alast, kaks kordust, homoloogne "zinc-finger" motiivile, selle ala kaudu toimivad DAG ja ilmselt ka cis-küllastumata rasvhapped. Kui sinna seostub DAG, siis inhibiitor-ala ei saa katalüütilist tsentrit blokeerida ja ensüüm on aktiivne; see ala osaleb ka membraaniga sidumises; selle alaga seostuvad forboolestrid ja aktiveerivad PKC. c2 - selle ala kaudu toimib Ca2+ ; uutel PKC-del on see ala muutunud ja ei seo Ca või puudub hoopis; ebatüüpilistel PKC vormidel see ala puudub, ja nad ei ole Ca-ioonidega aktiveeritavad. Ebatüüpilised PKC vormid on peale c2 kaotanud ka osa c1 motiivist, sisaldades ainult ühte tsüsteiini-rikast ala, nad ei vaja aktivatsiooniks ei Ca-ioone ega DAG; küll aga on aktiveeritavad cis-küllastumata rasvhapetega ja PS-ga. Katalüütilise ja regulaator ala vahele jääb hinge regioon (v3), kui sealt proteaasiga lõigata, tekib pidevalt aktiivne PKC vorm, mis koosneb ainult katalüütilisest alast. Katalüütilises alas on ATP sidumise koht (c3) ja kinaasse aktiivsuse ala (c4). Need piirkonnad on kõigil PKC valkudel olemas.
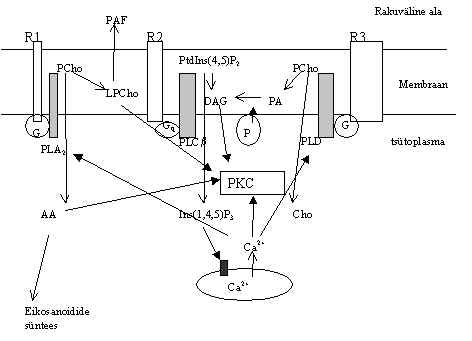
PKC aktiveeritakse mitmete retseptorite stimuleerimisel. Pildil 25 on mõned PKC aktivatsiooni teed, kui on G-valguga seotud retseptor ja see aktiveerib fosfolipaase.
Pilt 25. PKC aktivatsiooni skeem.
Retseptori stimuleerimisel aktiveeritakse üle vastavate G-valkude fosfolipaasid (PLA, PLC, PLD). PLA hüdrolüüsib fosfatidüül-koliini (PCho) andes arahhidoonhappe (AA) ja lüsofosfatidüül-koliini (LPCho). Gq -ga seotud PLCb toimel saadakse fosfatidüül-inositoolbis-fosfaadist (PtdIns4,5P2 ) diatsüülglütserool (DAG) ja inositool-trisfosfaat (InsP3). PLD toodab fosfatidüül-koliinist koliini (Cho) ja fosfatidüülhapet (PA), viimane muudetakse fosfataasi (P) abil DAG-iks. Vabanenud DAG, AA ja LPCho on kõik PKC aktiveerijad (mustad nooled). Ins(1,4,5)P3 initseerib Ca-ioonide vabanemise rakusisestest hoidlatest. Ca kontsentratsiooni tõus aktiveerib PKC, PLA ja PLD mõningaid alaliike. PKC võib fosforüleerida nii retseptoreid kui fosfolipaase, moduleerides sellega nende aktiivsust. Samal ajal kasutatakse tekkivaid rasvhappeid kohe edasi rakust sekreteeritavate ainete sünteesiks: PAF (platelet activating factor) saadakse lüsofosfatidüül-koliinist atsetüleerimise teel, arahhidoonhappest sünteesitakse eicosanoide, mis võivad olla mõnedes süsteemides rakkude vahelisteks signaali vahendajateks. Rakust viiakse välja ka lüsofosfatidüül-hape. Rasvhapete metaboliidid reguleerivad ka teiste valkude aktiivsust, inhibeerivad mõningaid GTP-aase, aktiveerides GTP-aasi inhibiitor-valke (GIP) või inhibeerides GTP-aasi aktivaatoreid (GAP).
6.3. PKC poolt aktiveeritud transkriptsiooni faktorid.
Mis saab edasi, kui PKC on aktiveeritud? PKC fosforüleerib paljusid raku valke, mõjutades küll raku pinna retseptorite tööd, küll tsütoplasmaatilisi retseptoreid (näiteks, dioksiini retseptori aktiivsus on sõltuvuses PKC-st). PKC esineb tsütosoolsena ja membraan-seoselisena. Viimase osa suureneb retseptorite aktiveerimisel, PKC aktivatsiooniga kaasneb PKC liikumine membraanile. PKC mitmeid liike on ka tuumas leitud, seda nii raku kultuurides kui ka mõnedes kudedes (maks, aju). Klassikalist tuuma lokalisatsiooni signaali PKC-des ei ole. Substraatideks tuumas võivad olla polümeraasid, topoisomeraasid, Fos, CREB, p53, lamiin, histoonid - nende kõigi fosforüleerimist PKC-ga on näidatud in vitro tingimustes.
Praeguseks on defineeritud DNA piirkond, mille kaudu PKC mõjutab esmase vastuse geenide ekspressiooni. See on TRE järjestus, TPA response element. TPA on üks forboolester (12-o-tetradecanoyl-phorbol-13-acetat), mis aktiveerib PKC. Sellel ühendil on veel teine nimetus: forbool-12-müristaat-13-atsetaat, ingliskeelne lühend PMA. Kirjanduses on kasutusel mõlemad lühendid TPA ja PMA.
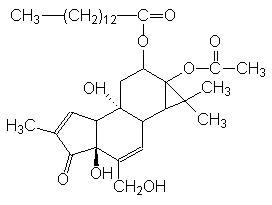
Pilt 26. PKC aktiveerija TPA e. PMA.
Nagu näha Pildil 26, sisaldab TPA ka küllastunud rasvhapet (C14 müristiinhape) nagu DAG, aga küllastumata rasvhapet ta ei sisalda. TPA aktiveerib PKC sama valgu osa kaudu kui DAG, kuid kui DAG on kiiresti lagunev ühend rakus, siis TPA ei lagune ja PKC jääb pikaks ajaks aktiivseks ja seotuks membraaniga. Tänu sellisele pikaajalisele PKC aktivatsioonile on TPA abil leitud DNA lõik, mis vahendab PKC toimet. TRE järjestusele seostuvad AP-1 valgud. AP-1 oligi algselt defineeritud kui DNA-siduv aktiivsus, mis tunneb ära TRE ja vastutab geenide induktsiooni eest PKC aktivatsiooni järel. AP-1 rühmas on rida struktuurselt lähedasi transkriptsiooni faktoreid, sealhulgas Jun- ja Fos-perekonda kuuluvad faktorid. PKC aktivatsioonil Jun-valk fosforüleeritakse transaktivatsiooni alas N-otsas, ta moodustab teiste Jun-valkudega homo- või heterodimeere, ja seostub DNA-le; see kompleks aktiveerib ka Fos-valgu ekspressiooni. Edasi võivad transkriptsiooni aktiveerida juba Jun-Fos heterodimeerid. cJun valk fosforüleeritakse Ser 63 ja Ser 73 kohalt ja see suurendab tema transkriptsiooni aktiveerivat võimet, mitte-stimuleeritud rakkudes on fosforüleeritus neis kohtades madal. Kui Jun fosforüleeritakse C-terminaalsest osast, kus on DNA-ga seostumise koht, siis DNA-ga seostumine on takistatud ja transkriptsiooni aktivatsioon ka. Hüperfosforüleeritud Fos- ja Jun-valgud ei ole enam aktivaatorid. C-otsast fosforüleeritud Fos-valk on juba enda geenile repressoriks. Nii et transkriptsiooni faktori fosforüleerimine võib olla faktorit aktiveeriv ja ka inhibeeriv, olenevalt fosforüleerimise kohast. Selline mehhanism tagab tuuma siseste signaali vahendajate (Fos, Jun) lühiajalise aktivatsiooni.
6.4. Kokkuvõte PKC osalusel kulgevast signaali teest.
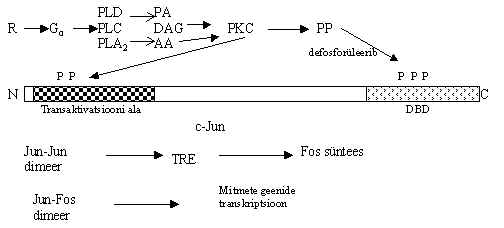
Pildil 27 on kokkuvõte PKC osalusel kulgevast signaali teest. Stimuleeritud retseptor aktiveerib Gq valgu, edasi aktiveeruvad fosfolipaasid PLC, PLD ja PLA2 ja toodavad madalamolekulaarseid signaali kandjaid DAG, PA, AA, IP3. Need omakorda aktiveerivad PKC, mis fosforüleerib mitmeid valke ja moduleerib nende aktiivsust. Transkriptsiooni faktoreist on Jun-perekonna valgud fosforüleeritavad PKC-ga transaktivatsiooni alast. PKC substraadiks on ka proteiinfosfataas PP, mis defosforüleerib Jun valgu DNA-ga sidumise alast ja soodustab sellega faktori seostumist DNA-le. Nii et PKC aktiveerib Jun-valku otsese fosforüleerimisega, aga ka üle proteiinfosfataasi aktivatsiooni. Viimane tee soodustab faktori DNA-ga sidumist, kui faktor DNA-le ei seostu, pole ka transaktivatsiooni võime tõstmisest suurt kasu. Selline kahepoolne mehhanism tagab Jun-valgu kui transkriptsiooni aktivaatori töö. C-otsast fosforüleerivad Jun-valku DNA-sõltuv kinaas ja kaseiin-kinaas II ja mõned MAP kinaasid, need alandavad Jun-valgu seostumist DNA-ga. Aktiveeritud Jun dimeriseerub andes homodimeere või heterodimeere teiste sama perekonna valkudega. Dimeerid seostuvad TRE alale ja aktiveerivad kõigepealt Fos-valgu sünteesi. Edasi toimivad Jun-Fos dimeerid uutele TRE järjestustele.
Pilt 27. PKC transkriptsiooni faktorite aktiveerijana.