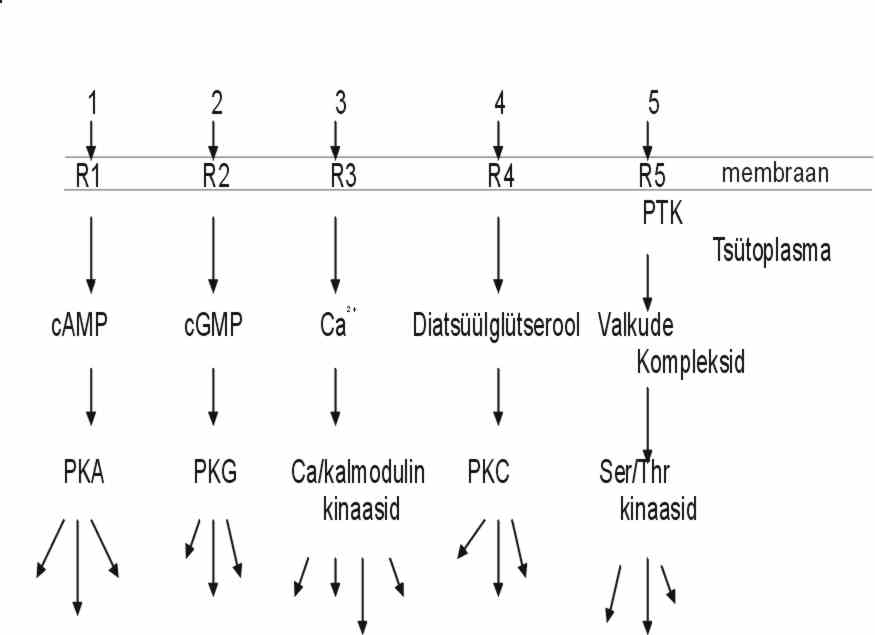
Mis saab edasi, kui retseptor on aktiveeritud? Aktiveeritud retseptor käivitab rakus rea keemilisi reaktsioone, millede abil signaal rakus liigub ja jõuab tuuma. Praeguseks on välja selgitatud mitu erinevat signaali teed, mis on toodud pildil 6.
Esimeses lähenduses võib öelda, et esimesed 4 kujutatud teed algavad kas ionotroopselt või metabotroopselt retseptorilt, on aktiveeritavad neurotransmitteritega, valgusega, lõhna- või maitseainetega. Retseptori aktivatsioonile järgneb kas G-valkude kaudu mingte ensüümide aktiveerimine või otse ioonkanalite avanemine. Seejärel tõuseb rakus madalamolekulaarsete signaali vahendajate kontsentratsioon: cAMP, cGMP, diatsüülglütserool (DAG), Ca-ioonid jt. Siin toimub signaali võimendumine - ühest signaalist saab palju cAMP või DAG molekule. Need aktiveerivad proteiinkinaase (PKA, PKC jt). Valkude fosforüleerimine on üks olulisemaid modifikatsioone, mis signaali ahelas toimub. Iga signaali ahela lüli aktiveerimine on lühiajaline. Parallelselt kinaasidega aktiveeritakse ka fosfataasid, mis defosforüleerivad valke. Signaali liikumine vajab energiat. Metabotroopselt retseptorilt e. G-valguga seotud retseptorilt algav signaali tee kasutab esimeses etapis GTP energiat, kui G-valk hüdrolüüsib GTP, ja teises etapis ATP energiat, sest aktiveeritud proteiinkinaasid kasutavad ATP, et fosforüleerida oma substraate. Need signaali teed reguleerivad raku metabolism, mingit sekretsiooni, liikumist, närviimpulssi jne. Viimasel ajal on näidatud, et need signaali teed võivad reguleerida ka rakkude kasvu ja diferentseerumist koopereerudes kasvufaktorite retseptoritelt algava signaali teega.
Viies tee on kasvufaktorite poolt aktiveeritav, määrab ära rakkude kasvu ja diferentseerumise. Sellel teel on signaali vahendajad valgud, põhiliselt rakuliste onkogeenide produktid. Siin teel ei ole seni kirjeldatud ühtegi madala molekulaarset signaali vahendajat. Mõne hüpoteesi järgi ongi siin ainult valk-valk interaktsioonid signaali edasdamiseks, nii ei toimu signaali võimendumist ja signaali liikumune on täpsem. Signaali edasi andmiseks moodustuvad suured valkude kompleksid, signaali transduktsiooni kompleksid. Need kompleksid moodustuvad kas aktiveeritud retseptori külge või mõne tsütoplasmaatilise valgu ümber. Paljud selle tee retseptorid on ise proteiin-türosiinkinaasid (PTK), või on võimelised aktiveerima tsütoplasmaatilisi proteiin-türosiinkinaase. Proteiin-türosiin-kinaasselt retseptorilt algav tee kasutab esimeses etapis ATP energiat, fosforüleerides türosiini, ja teises etapis GTP energiat. Signaali ülekande kompleksi tuuakse ka G-valgud, mis hüdrolüüsivad GTP, aga need aktiveeritakse peale türosiinkinaase. Kõik türosiinkinaaside aktiveerimisega algavad signaali teed ei ole ühesugused. Praeguseks on erinev tee kirjeldatud interferooni toimele vastamiseks. See on nn. Jak-STAT tee, retseptori aktiveerimisele järgneb kohe transkriptsiooni faktori aktiveerimine. Mõnede kasvufaktorite retseptorid on seriin/treoniin-kinaasid, ka siis on signaali tee erinev türosiini fosforüleerimisega algavast teest. On retseptoreid, mis ei oma mingit ensümaatilist aktiivsust ja esimeses etapis ei aktiveeri ei kinaase ega GTP-aase, signaali tee käivitatakse tsütoplasmaatiliste faktorite abil. Valkude fosforüleerimine esineb ka sellel teel, aga hilisemas etapis. Osa kasvufaktoreid stimuleerivad ka G-valkudega seotud retseptoreid ja türosiinkinaasse retseptori aktiveerimisega kaasneb sageli ka PKC aktivatsioon. Nii et kasvufaktorite toime on laiem, kui ainult ühe kindla signaali tee käivitamine. Signaali ülekandesse on rakus segatud ka oksüdatsiooni/reduktsiooni protsessid, kuid nende mehhanismidest on veel vähe teada.
Joonisel 6 on mitu paralleelset teed, kuid tegelikkuses toimub signaali teede vahel palju ristumisi, kokkusulamisi, üksteise asendamisi jne.: kinaasid moduleerivad retseptoreid, üksteise aktiivsust ja teiste ensüümide aktiivsust. Ka madalamolekulaarsed signaali vahendajad nagu Ca-ioonid, tsüklilised nukleotiidid jt. reguleerivad mitmeid valke rakus, mitte ainult joonisel toodud kinaase. Signaali ülekande protsessi õppida on parem üksikute signaali teede kaudu, kuid tegelikult on rakus tegemist signaali võrguga, kus kõik teed on omavahel seotud.
3. cAMP vahendusel kulgev signaali tee.
See on kõige paremini uuritud signaali tee. 1956. aastast on teada, et cAMP vahendab adrenaliini mõju glükogeeni metabolismile, aktiveerib glükogeeni fosforülaasi. Selle alaste tööde eest sai Earl Sutherland 1971.a. Nobeli preemia. Selles valdkonnas on preemiaid veelgi. 1992.a. sai Nobeli preemia Edvin Krebs, kes on aastaid uurinud cAMP osa signaali ülekandes, sealhulgas mõju insuliini toimele. G-valkude uurijate tööd hinnati 1994.a. Nobeli preemiaga (A.G. Gilman ja M. Rodbell). Sellel teel retseptori aktivatsioonile järgneb heterotrimeersete G-valkude aktivatsioon.
3.1. G-valgud.
G-valgud on oma nime saanud sellest, et nad seovad GTP ja hüdrolüüsivad seda, s.t. on GTP-aasid. GTP-aasid osalevad rakus väga paljudes protsessides. Tuntakse monomeerseid GTP-aase ja multimeerseid. Metabotroopse retseptoriga on seotud heterotrimeerne G-valk. Selline G-valk koosneb kolmest subühikust: a, b, g. 1995-ndaks aastaks oli kirjeldatud 21 a, 5 b ja 11 g subühikut. a subühik on GTPaasset aktiivsust omav valk molekulmassiga 40-44 kDa. Seni kirjeldatud signaali ülekande protsessides on just a subühik enam levinud aktiivne signaali vahendaja, kuid b g dimeer võib olla ka signaali edastaja. Subühikud b ja g on väiksemad, vastavalt 35 ja 5-8 kDa. Paljud a - ja g -subühikud on translatsiooni ajal saanud endale N-otsa külge müristiinhappe jäägi, s.t. on müristüleeritud. See pole ainuke modifikatsioon neil, enamasti on nad ka palmitüleertud kas Cys 3, Cys 9 või Cys 10 juurest. Need modifikatsioonid võimaldavad G-valkudel membraaniga seostuda, kuna retseptor on membraanis, siis peab signaali vastuvõtja ka membraani lähedal olema. Palmitüleerimine ja depalmitüleerimine osalevad G-valkude aktiveerimisel. Valgu külge pandud rasvhappe jääk metaboliseerub kiiremini kui valk ise.
Heterotrimeersed G-valgud on jagatud rühmadesse vastavalt a subühikutele. Algselt jagati selle järgi, kuidas nad mõjuvad adenülaat-tsüklaasile: stimuleerivad - a s ja inhibeerivad - a i. Kõik a -alaühikud ei mõjuta adenülaat-tsüklaasi, mõned toimivad fosfolipaasidele ja mõne märklaud pole teada. On kirjeldatud nelja G-valgu rühma, mille a -subühikud gruppeeruvad aminohappelise koostise ja toime järgi. Tabelis 2 on toodud G-valkude a subühikute omadused nendes neljas rühmas.
Gs-valgud sisaldavad as-subühikut. Ühelt geenilt tuleb kahe erineva suurusega a s-subühiku valku 44,2 ja 45,7 kDa. Need valgud ekspresseeruvad kõigis rakkudes, on koolera toksiinile (CTX) tundlikud, seostuvad mitmete retseptoritega, stimuleerivad adenülaat-tsüklaasi (AC). Siia rühma kuuluvad näiteks histamiini retseptoriga H2 seotud G-valk, adrenaliini b retseptoriga ja glükagooni retseptoriga seotud G-valk.
Adenülaat-tsüklaasi aktiveerivate G-valkude hulka kuulub ka lõhna retseptoritega seotud G-valk oma aolf subühikuga, ka see on koolera toksiinile tundlik, ekspresseerub haistmisneuroepiteelis.
Gi -valgud sisaldavad ai -subühikut, mida on teada mitu erinevat vormi, nad on tundlikud läkaköha tekitaja toksiinile (pertussise toksiin, PTX), inhibeerivad AC. Selle rühma a -subühikud avalduvad paljudes kudedes. Siia kuuluvad näiteks M2 ja M4 muskariini-atsetüülkoliini retseptoritega (M2 Ach), adrenaliini a 2 retseptoriga (a 2AR) seotud G-valgud. Aminohappelise sarnasuse põhjal on selles a -subühikute rühmas ka a 0-valgud, mis ekspresseeruvad põhiliselt ajus, on PTX-le tundlikud, toimivad fosfolipaasidele (PLC, PLA2). Siia kuuluvad ka oopiumi alkaloidide e. opioidide m -, d - ja k - retseptoritega ja met-enkephalini retseptoriga seotud G-valgud.
Gi –valkude rühmas on transdutsiin (transducin), tema GTP-aasne subühik on at, transdutsiin on esimene puhastatud G-valk. Ta seostub valgustundliku retseptoriga, rodopsiiniga. Rodopsiini polüpeptiid on tüüpiline metabotroopne retseptor, läbib 7 korda membraani, ta on seotud valguse tundliku kromofoori 11-cis-retinaaliga, mis läheb valguse toimel üle all-trans vormi ja sellega muudab rodopsiini struktuuri. Muutunud rodopsiin aktiveerib transdutsiini ja see aktiveerib cGMP spetsiifilise fosfodiesteraasi, mis hüdrolüüsib cGMP. cGMP kontsentratsiooni järsk langus põhjustab katiooni kanalite sulgumise plasma membraanis, see viib membraani hüperpolariseerumisele.
Ka maitse retseptoritega seotud G-valgud kuuluvad Gi-valkude rühma, nende a -subühik on a g, tema märklaud pole teada. Ajus ja neerupealises avaldub a z, mis on ühe muskariin-atsetüülkoliini retseptoriga M2 seotud ja inhibeerib AC.
Gq-valgud aktiveerivad fosfolipaase. Siin rühmas on näiteks M1, M3 ja M5 muskariin-atsetüülkoliini retseptoritega seotud G-valkude a -subühikud. Need ekspresseeruvad paljudes kudedes. Siia rühma on pandud veel mitmed G-valgu GTP-aassed subühikud, mis ekspresseeruvad T- ja B-rakkudes.
G12-valgud moodustavad omaette rühma, avalduvad paljudes kudedes, kuid milliseid signaali teid reguleerivad, pole teada, osalevad Na- ja K-ioonide taseme regulatsioonis.
Nagu tabelist näha töötavad mõned G-valgud ainult kindlas koes, teised on üsna laialt levinud. Üldiselt on G-valku rakus retseptoriga võrreldes ülehulgas, nii et aktiveeritud retseptor leiab G-valgu. Üks a -subühik võib olla signaali vastuvõtja mitmelt retseptorilt, samal ajal on leitud, et iga retseptor seostub kindla trimeeriga. Näiteks, muskariini retseptor M4 seostub a 01b 3g 4 heterotrimeeriga, muskariini retseptor M1 aktiveerib rakkudesse viidult a q, a 11, b 1, b 4, g 4 subühikud.
Tabel 2. Imetajate G-valkude a subühikute omadused
Subühik Mass,kDa Tundlikkus mürgile Kude, kus esineb Retseptor, millega seotud Mõju GS a s(s) 44,2 CTX igal pool glükagoon, H2, AC, Ca-kanalid a s(L) 45,7 CTX igal pool adrenaliini b , jt. Na-kanalite regulatsioon a olf 44,7 CTX haistmisneuroepiteelis lõhna retseptorid AC Gi a i1 40,3 PTX igal pool M2Ach, K-kanal a i2 40,5 PTX igal pool a 2 AR jt. ¯ Ca-kanal a i3 40,5 PTX igal pool ¯ AC a 0A 40 PTX ajus jm. Met-Enk, jt. PLC,PLA2 a 0B 40,1 PTX ajus jm. a AR jt. PLC,PLA2 a t1 40 CTX,PTX retina kolvikesed Rodopsiin cGMP-spets. fosfodiesteraas a t2 40,1 CTX,PTX retina kepikesed Cone opsin cGMP-spets. fosfodiesteraas a g 40,5 CTX,PTX maitse näsad Maitse rets a z 40,9 aju, neerupealised M2Ach ¯ AC Gq a q 42 igal pool M1Ach PLCb a 11 42 igal pool a AR, jt. PLCb a 14 41,5 kops, neer, maks a 15 43 B rakud, müeloidsed rakud a 16 43,5 T rakud, müeloidsed rakud G12 a 12 44 igal pool Na+/K+ regulatsioon a 13 44 igal pool
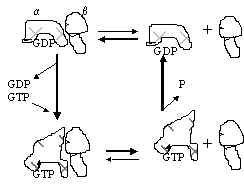
Pilt 7. G-valgu töötamise tsükkel.
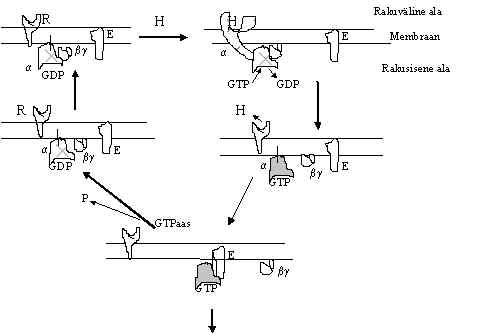
Pilt 8. G-valgu aktiveerimine retseptoriga (R).
Pildil 7 on G-valgu töötamise tsükkel. Trimeerne vorm dissotseerub a ja bg subühikuteks. Kui valk on seotud GDP-ga, siis on reaktsiooni tasakaal nihutatud trimeerse vormi poole; kui kompleksis on GTP, on tasakaal dissotsiatsiooni kasuks. G-valk seob nii GDP kui GTP ühesuguse affiinsusega. GDP asendamiseks GTP-ga on vaja, et GDP lahkuks sidumiskohalt. Kuna rakus on GTP kontsentratsioon kõrgem kui GDP kontsentratsioon, siis vaba koht täidetakse GTP-ga. Retseptori aktivatsioon soodustab GDP asendumist GTP-ga. a-GTP toimib GTP-aasina, GTP hüdrolüüsitakse ja kompleks on jälle GDP-ga.
Pildil 8 on G-valgu aktiveerimine retseptoriga ja signaali edastamine.Hormooni seostumine retseptoriga aktiveerib G-valgu, s.t. sunnib lahkuma GDP. Vaba G-valk seob GTP. Seega suurendab aktiveeritud retseptor GTP-ga seotud G-valgu hulka. GTP-ga seotud G-valk on signaali edastaja, sellises vormis aktiveerib ta järgmist lüli (E, Pildil 8). Kuna G-valk on GTP-aas, hüdrolüüsib ta seotud GTP. Kui GTP hüdrolüüsitakse läheb G-valk tagasi inaktiivsesse vormi – GDP-ga seotud vormi. Selles tsüklis võib vahele segada inhibeerides GTP sidumise või GTP hüdrolüüsi. Nendes kohtades toimivad pertussise ja koolera toksiinid: pertussise toksiin katalüüsib G-valgu a subühiku ühe tsüsteiini ADP-ribosüleerimist ja selline modifitseeritud a subühik ei seo GTP, G-valk ei aktiveeru; koolera toksiin kannab ADP riboosi a-subühiku arginiini jäägile ja sellega GTP-aasne aktiivsus inaktiveeritakse. Kui GTP ei hüdrolüüsita, siis G-valk jääb pikaks ajaks GTP-ga seotuks ja signaali edasi kandjaks - signaal jääb peale. Seda tsüklit saab liigselt aktiveerida ka hormooni ülehulgaga: retseptor on kogu aeg aktiveeritud ja signaal on peaaegu pidevalt peal, see võib põhjustada nn. stressi haigusi. G-valgu a subühiku mutatsioone, mis vähendavad GTP-aasset aktiivsust on leitud mõnedest kasvajatest, kus siis G-valk on signaali edastavas olekus pidevalt ja signaal jääb peale. Võrreldes mõnede teiste G-valkudega (Ras, EF-Tu) hüdrolüüsib G-valgu a subühik GTP üsna kiiresti ja sõltumata teistest faktoritest: k > 1min-1, võrdluseks on EF-Tu k=0,02min-1.
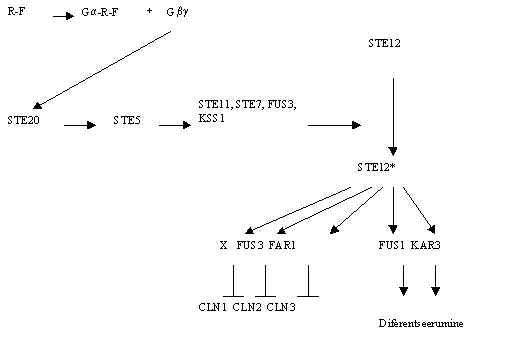
Ka bg subühik võib signaali edastada. Üks selline tee on kirjeldatud pärmis. Pildil 9 on G-valgust algav signaali tee pärmis. Teatud ajal toimub pärmi rakkude polariseerumine, ühed rakud hakkavad sekreteerima feromoni, millele teistel rakkudel on retseptor. Feromon seostub retseptoriga, metabotroopse retseptoriga, see aktiveerib G-valgu. Kui G-valgu a subühiku geen deleteerida, siis saadakse konstitutiivselt aktiivne signaali tee - tähendab, a subühik on siin negatiivne regulaator, bg subühik osaleb aktiivse signaali edastajana. Signaal kantakse edasi proteiin-kinaasidele (STE20, STE11, STE7, FUS3, KSS1) ja peale kinaaside rada aktiveeritakse transkriptsiooni faktorid (STE12), mis reguleerivad tsükliinide ja diferentseerumise valkude taset, blokeeritakse kasv ja käivitatakse diferentseerumine.
Pilt 9. Feromooni poolt aktiveeritav signaali tee Saccharomyces cerevisiae rakus.
3.2. Adenülaat-tsüklaas.
Imetajatel on Ga tavaliselt postiivne regulaator, signaali tee käivitaja. Kui retseptoriga on seotud Gs-valk, siis aktiveeritakse adenülaat-tsüklaas.
Pildil 10 on väga skemaatiliselt kujutatud adenülaat-tsüklaasi e. adanülüül-tsüklaasi (AC). AC on membraanne valk, M 120-150 kDa, 2 suurt transmembraanset piirkonda, kummaski alas läbib polüpeptiid 6 korda membraani; tsütoplasmas on 2 tsüklaasi aktiivsuse ala. Erinevalt guanülüül-tsüklaasist, AC ei oma ekstratsellulaarset ala, ta on reguleeritav transmembraanse ja tsütoplasmaatilise ala kaudu.
Pilt 10. Adenülaat-tsüklaas.
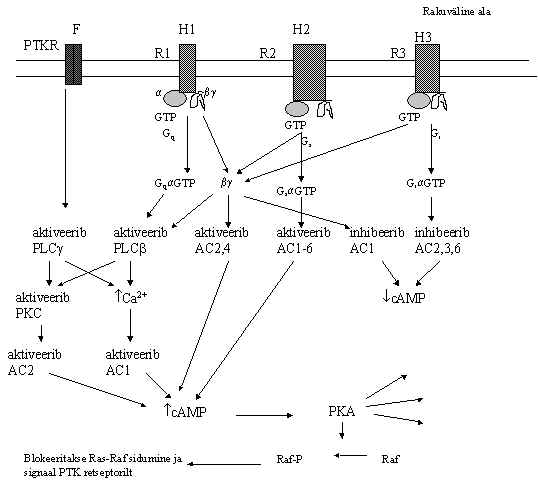
Nagu retseptoreid ja G-valke on ka adenülaat-tsüklaase palju. On kirjeldatud 6 erinevat AC, mis on reguleeritavad erinevate retseptorite poolt. Paljud retseptorid mõjutavad cAMP taset rakus. Pildil 11 on toodud ülevaade AC vormide regulatsioonist. Kolm erinevat G-valguga seotud retseptorit (R1, R2, R3) on aktiveeritud vastavate ligandidega, näiteks hormoonide poolt (H1, H2, H3). Türosiinkinaasne retseptor (PTKR) on aktiveeritud kasvufaktori (F) poolt. Kuus AC on aktiveeritavad GsaGTP poolt; AC 2,3,6 on inhibeeritavad GiaGTP-ga; bg subühik inhibeerib AC1 ja stimuleerib AC2 ja 4. Gq-valgu kaudu aktiveeritakse PLCb ja edasi Ca-ioonide kontsentratsiooni tõus stimuleerib AC1 ja PKC aktiveerib AC2. Paljude retseptorite aktivatsioon põhjustab cAMP tõusu. Siin skeemil võib näha mitme signaali tee ristumist, cAMP taset ei reguleeri ainult Gs-valk, vaid seda mõjutavad ka muutused PKC ja Ca-ioonide tasemes. Türosiinkinassed retseptorid võivad tõsta cAMP taset üle PKC aktivatsiooni. Samal ajal cAMP poolt aktiveeritud PKA võib blokeerida türosiinkinaasselt retseptorilt alanud signaali tee fosforüleerides Raf valgu ja takistades tema sidumist Ras valguga.
Pilt 11. Erinevate adenülaat-tsüklaaside regulatsioon.
Adenülaat-tsüklaas toodab tsüklilist AMP. Tsükliline AMP on madalamolekulaarne signaalikandja sellel teel.
ATP ® cAMP ® AMP
AC Fosfodiesteraas
Adenülaat-tsüklaasi ja cAMP fosfodiesteraasi tasemest sõltub rakus cAMP kontsentratsioon. Kui AC aktiveeritakse, tõuseb cAMP hulk; kuna cAMP aktiveerib ka teda ennast lagundavat fosfodiesteraasi, siis cAMP tase tõuseb ainult korraks. Signaali transduktsioonile on iseloomulik lühiajaline ensüümide aktivatsioon ja signaali vahendaja taseme tõus.
Selles etapis toimub signaali võimendumine: ühest retseptorilt tulnud signaalist saab kümneid cAMP molekule, mis viivad signaali edasi. cAMP annab signaali edasi proteiin-kinaasile A (PKA).
3.3. Proteiin-kinaas A (PKA).
Proteiin-kinaas A on tetrameerne ensüüm (imetajate puhul), koosneb kahest regulatoorsest (R) ja kahest katalüütilisest (C) subühikust - R2C2 , ta seob 4 molekuli cAMP. On teada 3 katalüütilise subühiku isovormi Ca, Cb, Cg ja 4 regulatoorse subühiku isovormi RIa, RIb, RIIa, RIIb. Need avalduvad erinevates kudedes erinevalt, b isovormid avalduvad närvikoes. Regulaator-subühiku järgi saadakse kas RI tüüpi või RII tüüpi ensüüm. RI isovormid on põhiliselt tsütosoolis. RII isovormid on lokaliseeritud spetsiifiliste ankur-valkude abil tsütoskeletiga, selle sidumise eest vastutab RII N-terminaalse osa 50 aminohapet, see järjestus seostub mikrotorukestega assotseerunud valguga. RII võib interageeruda kinaasiga p34cdc2. Kui see kinaas fosforüleerib RII subühiku treoniini jäägi 211, siis see regulaator-subühik ei seo enam cAMP ja ensüüm ei ole aktiveeritav cAMP-ga.
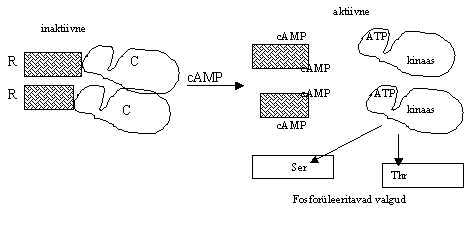
Pildil 12. on skeem PKA aktivatsioonist. PKA katalüütiline subühik sisaldab kinaasse ala, mis on kõigis proteiin-kinaasides üsna konserveerunud. Kinaasidele on iseloomulik kahe sagaraline molekul, väiksem osaleb ATP sidumises, suurem seob valku ja katalüüsib fosforüleerimise. Kahe sagara vaheline ala on hõivatud Mg ja ATP poolt.
Kui cAMP seostub R-subühikuga, vabaneb katalüütiline subühik ja läheb tuuma. R-subühik jääb tsütoplasmasse, ka see, mis ei ole ankurdatud tsütoskeletiga (RI-isovormid). Rakku viidud eksogeenne PKA jääb tsütoplasmasse kuni cAMP tase on madal, pärast cAMP taseme tõusu (üle100 nM) PKA tetrameer dissotseerub ja katalüütiline subühik läheb tuuma. Kui cAMP kontsentratsioon tsütoplasmas langeb, katalüütiline subühik tuleb tuumast ära ja seostub uuesti R-subühikuga tsütoplasmas.
PKA fosforüleerib paljusid raku valke, nende seriini ja treoniini jääke. Sobiv järjestus on HMRSSMSGLHLVKQG või üldisemalt RRXSY(hüdrofoobne ala). PKA on seriin/ treoniin proteiin-kinaas.
Pilt 12. PKA aktiveerimine cAMP-ga.
3.4. cAMP poolt reguleeritav transkriptsiooni faktor.
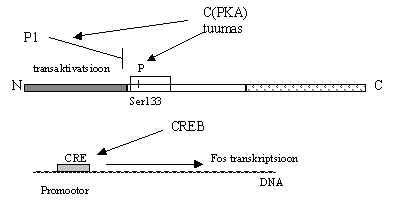
Tuumas on PKA substraadiks CREB (cAMP response element binding protein). See on cAMP-ga reguleeritav transkriptsiooni faktor, ta seostub nendele promootoritele, mis on cAMP-ga aktiveeritavad. Nii et cAMP aktiveeriv toime jõuab DNA-le PKA ja CREB vahendusel. CREB aktivatsioon toimub 30 min. jooksul peale retseptori stimuleerimist ja langeb algsele tasemele 24 tunni pärast. CREB sisaldab 3 fosforüleerimise kohta N-terminaalses alas, nendest Ser 133 on PKA substraat ja selle fosforüleerimine tõstab CREB transkriptsiooni aktivatsiooni võimet 10-20 korda. Ser 121 on PKC substraat ja Ser 133 ning 156 on Ca/kalmoduliini kinaasi substraadiks in vitro. Selle piirkonna fosforüleerimine ei mõjuta aga DNA-ga sidumise võimet. CREB valku defosforüleerib proteiin-fosfataas 1 (P1), mis on ka omakorda PKA substraat ja tema poolt aktiveeritav. Järelikult on CREB fosforüleeritus lühiajaline. CREB valgu N-terminaalne ala on transkriptsiooni aktivaator, COOH-ots on DNA-ga sidumise ala ja fosforüleerimise kohad on regulaator alas (tume raam pildil 13). CREB valku sünteesitakse konstitutiivselt, ta kuulub nn.BZip valkude rühma, need on aluselist piirkonda (B) ja "leucin zipper" motiivi sisaldavad valgud. CREB-ga ühte perekonda kuuluvad ka transkriptsiooni faktorid ATF-1 ja 2. CREB on pidevalt seotud DNA-ga alas, mida nimetatakse CRE (cAMP respons-element). Kui valk fosforüleeritakse Ser 133 kohalt, siis muutub ta transkriptsiooni aktivaatoriks, Ser asendamine selles positsioonis inaktiveerib valgu. CREB toimet moduleerib teine valk CREM (CRE modulaator). See valk seostub CREB-ga. CREB/CREM heterodimeer reguleerib negatiivselt cAMP indutseeritud transkriptsiooni. Kuigi CREM negatiivne mõju ei ole absoluutne. CREM-valke on kirjeldatud 6-7 ja mõned neist on aktivaatorid nagu CREB.
CRE järjestus on mitmete geenide promootorites, sealhulgas ka nn. esmase vastuse geenide promootorites: c-fos promootoris, c-jun promootoris. Need on geenid, mille transkriptsioon käivitatakse vastuseks paljudele signaalidele. Transkriptsioon aktiveeritakse lühikeseks ajaks nagu kõik signaali kandmise lülid. Nende geenide produktid on transkriptsiooni faktorid, mida võib vaadata tuuma-siseste signaali vahendajatena. c-Fos geen aktiveeritakse 30 min jooksul peale retseptori stimuleerimist ja mõne tunni pärast on tema transkriptsioon juba lõppenud. Esmase vastuse geenide promootorites on rohkem regulaator-elemente kui CRE, ja nad käivituvad mitmesuguste signaalide peale. Negatiivselt reguleerib c-fos ekspressiooni c-Fos valk ise: kui ta fosforüleeritakse PKA abil Ser 361 kohalt, siis on ta enda geeni repressor. Nii et PKA aktiveerib üle CREB Fos-valgu sünteesi, ja kui seda on juba piisavalt fosforüleerib ta Fos-valgu ja see pärsib enda sünteesi. Fos- ja ka Jun-valgu mRNA on väga lühikese elueaga, nende 3’UTR alas on mRNA degradatsiooni soodustavad järjestused. Fos-geeni transkriptsioon võib peatuda 1. intronis, kui ei ole Ca-ioonide tase piisavalt kõrge, selle bloki võtab maha Ca lisamine. Esmase vastuse geenide ekspressioon on ühelt poolt mitmekordse kontrolli all ja teiselt poolt aktiveeritav paljude signaalidega.
Pildil 13 on lühike kokkuvõte cAMP signaali teest. Hormoon aktiveerib retseptori, mis on seotud G-valguga. G-valk aktiveerib AC, cAMP tase tõuseb, ta seostub PKA regulaator-subühikiga (R). PKA katalüütiline subühik dissotseerub, regulaator-subühikud jäävad tsütoplasmasse, katalüütiline subühik (C) läheb tuuma, aktiveerib CREB, fosforüleerides seda regulaatoralast ja see käivitab transkriptsiooni, sünteesitakse transkriptsiooni faktoreid (Fos). PKA poolt aktiveeritud proteiinfosfataas P1 defosforüleerib Ser 133 ja CREB transkriptsiooni aktiveeriv toime kaob.
Pilt 13. cAMP poolt vahendatud signaali tee.
H® R® Gs a ® AC® cAMP ® cAMP-R(PKA)-cAMP tsütoplasmas