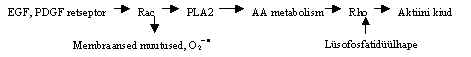III SIGNAALI ÜLEKANNE JA ONKOGENEES
Organismis on igal rakul oma koht, arengu tee ja funktsioon. See on tagatud õige informatsiooni vahetusega keskkonna ja raku vahel. Kui mõni rakk hakkab kontrollimatult kasvama, muutub kasvaja rakuks, siis on tegamist onkogeneesiga. Selle protsessi käivitamiseks on raku tasemel kolm põhjust: 1) rakk saab pidevalt valesid signaale keskkonnast, 2) signaali ülekandes on viga, 3) viga on raku vastuses. Kasvaja kudede uurimisel on leitud muutusi kõigis kolmes etapis: on muutunud signaalainete, hormoonide ja kasvufaktorite, tootmine; on muutunud signaali ülekande ahelas osalevate valkude omadused ja on muutunud raku kasvu kontrollivad süsteemid, mutatsioonid on tuumor-supressor-geenides. Kas need muutused on onkogeneesi põhjus või tagajärg, ja millne muutus on põhjus ja milline tagajärg, see pole selge. Antud loengu kursuses püüame vaadata, millised muutused on toimunud signaali ülekande valkudes kasvajalistes kudedes, millised signaali ülekande valgud võivad eksperimendi tingimustes rakke transformeerida ja kuidas mõjutavad mitmed viiruselised onkovalgud signaali ülekande protsessi. Onkovalk on selline valk, mis on teatud tingimustel võimeline rakke transformeerime, s.t. muutma neid kasvajalisteks rakkudeks. Kuna rakkude kasv ja diferentseerumine on olulisel määral kasvufaktorite retseptoritelt algava signaali tee kontrolli all, sellel teel on kõik signaali kandjad rakuliste onkogeenide produktid, siis selle osa onkogeneesis me antud loengutsüklis põhiliselt vaatamegi. Ainult väga lühidalt peatume G-valkudega seotud retseptoritest lähtuval onkogeneesil.
1. G-valkudega seotud retseptorid ja onkogenees
Kuigi G-valkudega seotud retseptorilt lähtuvates signaali teedes ei osale rakuliste onkogeenide produktid, ei saa väita, et need teed pole olulised, rakus on kõik signaali teed üksteisega läbi põimunud. Kasvaja koes on muutunud ka neurotransmitterite ja hormoonide poolt käivitatavad signaali teed. Hormooni tootmine võib olla tõusnud ja see aktiveerib mitmeid protsesse rakus. Selline parakriinne või autokriinne 7x membraani läbiva retseptori stimuleerimine on leitud paljudes kasvajates, eriti neuropeptiidide retseptorite puhul. Näiteks, väikese rakulise kopsuvähi kude sekreteerib bombesiini, bradikiniini, galaniini, neurotensiini ja see stimuleerib rakkude kasvu. Inimese kartsinoomist on eraldatud mas-geeni produkt, mis on 7x membraani läbiv retseptor ja võib olla onkogeenne. Selle retseptori loomulik ligand pole teada. On leitud, et serotoniini 1C retseptori ekspressioon NIH3T3 rakkudes serotoniini juuresolekul on transformeeriv. Neid rakke transformeerivad ka mAch retseptorid m1, m3 ja m5 ligandist sõltuvalt. Need muskariini retseptorid aktiveerivad heterotrimeerseid Gq-valke. Gi-valkudega seotud mAhc retseptorid m2 ja m4 ei ole transformeerivad. Kui agonistiga retseptori aktiveerimine võib viia transformatsioonile, siis on võimalikud ka sellised retseptori mutatsioonid, mis muudavad retseptori onkogeenseks. Tegelikult ongi selliseid mutantseid retseptoreid leitud: Ga 1b-valguga seotud noradrenaliini retseptor on oma membraani lähedase ala mutatsiooni läbi muutunud ligandist sõltumatuks transformeerivaks retseptoriks.
G-valkudega seotud retseptori geene on leitud mõnede viiruste genoomist, sealhulgas inimese tsütomegaloviiruse (HCMV), herpes-viirus-saimiri (HVS), Kaposi sarkoomiga seotud herpesviiruse genoomist. HSV genoomis on IL8 retseptori analoog.
Kasvajatest on leitud muteerunud G-valgu a -subühikuid, need on pidevalt aktiivsed signaali edastajad. Ga s, Ga i ja Ga 12 onkogeenseid vorme on teada: gsp, gip2 ja gep onkogeenid vastavalt. Need muteerunud G-valgud võivad mitmetes raku tüüpides olla transformeerivad.
Gq-valkudega seotud transformeerivad retseptorid aktiveerivad fosfolipaas C (PLC) ja edasi proteiinkinaas C (PKC). Mitmete PKC alaliikide ületootmine rakus on transformeeriv. Tuntud PKC aktivaator TPA (tetradekanoüül-forbool-atsetaat) on vähki tekitav ühend. Mitmed onkogeensed viirused aktiveerivad PKC.
Kasvaja koes on muutunud rakkude omavahelised kontaktid. Mitmed raku pinna valgud, mis vahendavad rakk-rakk interaktsioone (integriinid, kadheriinid jt.), on kasvaja koes muutunud, nende poolt indutseeritavad signaali teed on ka muutunud.
Kuidas G-valguga seotud retseptor ja tema poolt käivitatud signaalitee koos PKA ja PKC aktivatsiooniga transformatsioonis osaleb, pole selge. Mitmed tööd näitavad, et G-valkudega seotud retseptor aktiveerib Src-kinaasi ja retseptor-türosiin-kinaase, sealjuures signaali vahendajaks peetakse G-valgu b g -subühikut. Nii et kasvu signaal jõuab ikka välja Ras-Raf-MAPK signaali teele, s.t. kasvufaktorite retseptoritelt algavale teele.
2. Kasvufaktorid ja onkogenees
Kasvufaktorid toovad rakkudeni signaali kasvuks või diferentseerumiseks. Ühed rakud toodavad mingit faktorit, teised vastavad sellele. Näiteks, vigastuste puhul toodavad trombotsüüdid PDGF (trombotsüütide pärane kasvufaktor), fibroblastid vastavad sellele hakates kasvama ja haav paraneb. Signaal on lühiajaline: kui vigastus on parandatud, PDGF tase langeb ja rakkude kasv lakkab. Teine olukord on krooniliste vigastuste puhul koes. Siis on PDGF tase pidevalt kõrge, pidevalt stimuleeritakse rakkude kasvu. Milline rakk haiges koes toodab faktorit, ja milline retseptorit, on raske öelda. Kuid mitmed inimese sarkoomi rakuliinid on muutunud PDGF tootvaks liiniks. Faktorit toodab siin sama rakk, mis sellele vastab. See on autokriinne stimuleerimine ja see võib viia kontrollimatule kasvule, immortalisatsioonile. Kui kasvufaktori tootmise supressioon on häiritud, faktorit toodetakse liiga palju, siis võib täiesti normaalne faktor olla transformeeriv onkovalk.
PDGF B ahel on c-sis geeni produkt. Tema homoloog leiti olevat ahvide sarkoomi viiruse (simian sarcoma virus) onkogeen - v-sis. Selle ekspressioon fibroblastides viib rakkude transformatsioonile.
Paljud kasvufaktorid ekspresseeruvad normaalselt ainult embrionaalses arengu etapis. Kasvajalised rakuliinid hakkavad neid faktoreid pidevalt tootma ja nii stimuleeritakse pidevalt rakkude kasvu. Fibroblastide kasvufaktorid - aFGF, bFGF, K-FGF jt. on proto-onkogeenide (int, hst) produktid.
Kokkuvõtteks võib öelda, et stimuleerivad kasvufaktorid muutuvad transformeerivateks onkovalkudeks kui neid toodetakse vales kohas, valel ajal või liiga palju.
On olemas ka inhibeerivad kasvufaktorid. Need on sellised faktorid, mis inhibeerivad rakkude kasvu või viivad rakud apoptoosi. Siia rühma kuuluvad TNF (tumor necrosis factor) ja TGFb (transformeeriv kasvufaktor). TNF toodavad peamiselt makrofaagid ja monotsüüdid, aga ka paljud teised rakud. Ta on signaali vahendaja põletikulistes protsessides ja immuun-vastuse kujunemisel. Ta võib esile kutsuda rakkude nekrootilist ja apoptootilist surma. Nii TGFa kui TGFb indutseerivad fibroblastide transformatsiooni rakukultuuris, stimuleerivad kolooniate moodustumist, sellest on nad saanud oma nime. TGFb on multifunktsionaalne, võimeline stimuleerima ja inhibeerima kasvu, käivitama või inhibeerima rakkude liikumise, aktiveerima PDGF. TGFb võib olla aga paljudele rakkudele kasvu inhibiitor. TGFb 1,2 ja 3 on leitud imetajatel. Sünteesitakse suurte polüpeptiididena ja lõigatakse hiljem 12,5 kDa monomeerideks.
3. Retseptorite ekspressioon ja onkogenees
Nii stimuleerivad kui ka inhibeerivad faktorid saavad toimida neile rakkudele, mis ekspresseerivad vastavaid retseptoreid.
TGFb jaoks on 2 retseptorit. TGFb retseptorid on seriin/treoniin kinaasid, mis edastavad kasvu inhibeerivaid signaale. Kasvajalistes rakuliinides sageli neid retseptoreid ei ole või on muteerunud. Näiteks, retinoblastoomi rakuliinis ei ole TGFb retseptorit ja tema kasvu TGFb ei inhibeeri. Selle rakuliini normalne eellane omab kõiki neid retseptoreid ja on reguleeritav TGFb -ga. TGFb retseptor II geen on inaktiivne käärsoole kasvajas (colon carcinoma), seal on sageli muteerunud või deleteerunud ka TGFb signaali vastuvõtvate ja edastavate valkude geenid. Signaali vastuvõtjad on siin Smad-valgud. Smad-valgud on tuumor-supressorid, nad vahendavad kasvu inhibeerivaid käske. Smad-valgud on fosforüleeritavad MAPkinaaside poolt. MAPK üleaktivatsioon võib TGFb toime blokeerida. Kui Smad-valkudes on mutatsioonid, neid ei fosforüleerita õigest kohast või need geenid on inaktiivsed, siis TGFb tee ei toimi. Näiteks, pankrease kasvajas on Smad4 geen deleteerunud, Smad4 mutatsioonid on veel käärsoole, rinna, munasarja, kopsu jt. kasvajates.
PDGF retseptori ekspressioon on rakukultuuris kasvavates normaalsetes fibroblastides sõltuv söötme seerumi kontsentratsioonist: kui on vähe seerumit, siis retseptori ekspressioon tõuseb. Transformeerunud rakkudes retseptori ekspressioon langeb, need rakud kasvavad ka madala seerumiga söötmes; need rakud olid transformeeritud v-src või v-ras-onkogeenidega.
PDGF ja tema retseptorit peetakse onkogeneesis oluliseks ka selles osas, et nad osalevad kasvajakoes veresoonte tekitajana. Kasvaja rakud, mis produtseerivad PDGF, soodustavad kasvajas veresoonte arengut, see võimaldab suurte kasvajate tekkimist. Veresoonte arengut stimuleerivad ka fibroblastide kasvufaktorid (FGF). Paljud faktorid toimivad üle PDGF, indutseerides PDGF ja tema retseptori ekspressiooni. PDGF retseptori, s.t. PTK (proteiin-türosiin-kinaasi), inhibiitorid on potentsiaalsed vähi vastased ravimid.
Retseptorist sõltub ka see, kas TNF toimib kasvu stimulaatorina või suunab rakud apoptoosi. On kaks TNF retseptorit TNFR1 ja TNFR2. Kui TNF seostub retseptoriga TNFR2, aktiveeritakse rakkude kasv üle faktori TRAF2 (TNF retseptoriga assotseeruv faktor 2) ja NFk B aktivatsiooni. Kui TNF aktiveerib TNFR1, võidakse rakud apoptoosi suunata. Selleks peab TNFR1 siduma teisi faktorei TRADD (TNF retseptoriga assotseeruv surma domään) ja FADD (Fas-ga assotseeruv surma domään). Nii et üks kasvu reguleeriv valk võib anda erinevad vastused, olenevalt sellest, millise retseptoriga ta seostub ja millised signaali vastu võtvad valgud rakus ekspresseeruvad.
4. Viiruselised onkovalgud ja retseptorid
Mõned viiruse valgud võivad rakke transformeerida nii, et aktiveerivad mingi retseptori poolt kontrollitava signaali tee. Näiteks, Epstein-Barr viiruse (EBV) latentse infektsiooni membraanne valk LMP1 (latent infection membrane protein 1) on vajalik B-lümfotsüütide transformatsiooniks ja ainukese EBV valguna võib transformeerida ka mitte lümfoidseid rakke. Ta lokaliseerub rakus membraanis ja on võimeline oma tsütoplasmaatilise alaga siduma TRAF2, s.o. TNF retseptoriga seostuvat faktorit. Viimane põhjustab aga NFk B aktivatsiooni ja see võib viia transformatsioonile. Viiruse valk on membraanis pakitud nii, et ta matkib TNF retseptorit ja käivitab sellelt algava signaali tee. TNF trimeer seostub retseptoriga ja põhjustab selle ahelate trimeriseerumise ja seostumise rakusiseste valkudega. Nende rakusiseste valkude aktivatsiooni võib esile kutsuda ka LMP1 ilma TNF ja tema retseptorita.
Teine näide on papilloomi viiruse onkovalgust E5. See väike hüdrofoobne valk lokaliseerub nakatatud raku membraanis. See valk ei asenda retseptorit nagu teeb seda EBV valk LMP1, vaid seostub mõne kasvufaktori retseptoriga ja aktiveerib selle. Inimese papilloomi viiruse E5 võimendab kasvufaktorite effekti signaali tee aktiveerimisel. Rakkude transformatsiooniks on siin vaja nii E5 kohalolekut kui ka kasvufaktori toimet (EGF). Veise papilloomi viiruse BPV-1 onkovalk E5 on iseseisvalt võimeline rakke transformeerima, kui neis ekspresseerub PDGF retseptor. BPV E5 seostub membraanis PDGF retseptoriga ja aktiveerib signaali tee. See seostumine ja aktivatsioon on vajalikud rakkude transformatsiooniks. Kui PDGFr türosiin-kinaasne aktiivsus on rikutud või ei tööta signaali tee alumised lülid (Ras- ja Raf-valgud), siis BPV E5 ei transformeeri fibroblaste.
Nii et viiruse onkogeensed valgud võivad sekkuda rakkude ellu aktiveerides kasvufaktorite retseptoreid ja nendelt lähtuvaid signaali teid ilma kasvufaktorita (BPV E5) ja isegi ilma retseptorita (EBV LMP1). Seejuures on retseptorid ja nendega seostuvad faktorid täiesti normaalsed, ilma mutatsioonideta. Onkogeensus seisab selles, et signaali tee käivitatakse valel ajal ja kuna viiruse valku on palju, siis ka pikaks ajaks.
5. Onkogeensed retseptorid
Normaalne retseptor võib muutuda rakke transformeerivaks onkogeenseks valguks mutatsioonide ja teiste struktuursete muutuste läbi.
Mutatsiooni klassikaliseks näiteks on see kui roti EGF (epidermiaalne kasvu faktor) retseptor, mida kodeerib geen c-erb B, muutub rakke transformeerivaks valguks Neu ühe aminohappe asendamise tõttu transmembraanses alas. Valiin asendub glutamiinhappega positsioonis 664, T® A, üks nukleotiid on muutunud. See üks punkt-mutatsioon põhjustab pidevalt dimeerina oleva retseptori ja pidevalt aktiivse proteiin-türosiin-kinaasi. Selline valk on leitud roti neuro-glioblastoomist ja samuti etüülnitrosoureaga tekitatud kasvajatest. Homoloogne geen inimeses c-erb B-2 (HER2) annab inimese EGF retseptori valgu (HER2), p185c-erbB-2. Selle valgu üle-ekpressiooni on leitud mitmetes kasvajates, eriti rinnavähi puhul. Seal ei ole mutatsiooni roti valgule analoogses positsioonis, aminohappe asendamiseks oleks seal vaja kahte punkt-mutatsiooni, selle tõenäosus on väike. Kasvaja koes on aga leitud selle geeni amplifikatsiooni ja valgu üle-ekspressiooni. Kui retseptori valku toodetakes väga palju, esineb ta dimeerse vormina ka ilma stimulaatorita, ja annab pidevalt aktiivse retseptori. EGF retseptori ekstra-tsellulaarne ala lõigatakse sageli proteaasidega ära ja see vabanenud 130 kDa suurune valk võib olla rinna vähi diagnoosimisel oluline: selle valgu taseme tõus veres näitab selle geeni üleekspressiooni ja viitab võimalikule kasvajale.
v-erb B on c-erb B viiruseline homoloog, isoleeriti lindude leukeemia viirusest (avian erythroleukemia virus), ta on lühem rakulisest geenist, tal puudub negatiivse regulatsiooni ala N-otsas. Nii v-erb B kui kasvajatest eraldatud mutantsed c-erb B geenid on võimelised rakke transformeerima.
Peale mutatsioonide ja geeni amplifikatsiooni võivad onkogeensed retseptorid tekkida ka kromosomaalsete ümberkorralduste teel. Sel viisil tekivad hübriidsed valgud, milles üks pool on retseptor ja teine mingi dimeriseerumist soodustav valk.
Näited sellistest retseptoritest. 1) c-met lokaliseerub 7. kromosoomis, ekspresseerub valikuliselt ainult teatud rakkudes, kodeerib hepatotsüütide kasvufaktori (HGF) retseptorit, see on proteiin-türosiin-kinaas, tsütoplasmaatilises osas on PTK domään. Kasvajatest, inimese luusarkoomist ja ka keemilisel teel indutseeritud kasvajatest, on leitud pidevalt aktiivne kinaas. See sisaldab HGF retseptori kinaasset domääni ja selle ette on liitunud 1. kromosoomist pärit Tpr-järjestus (translocated promotor region). Sellise liitvalgu geen on võimeline transformeerima teisi rakke. Kui Met mRNA on 9 kb, siis liitvalgu mRNA on ainult 5 kb pikk, ekstratsellulaarne ala puudub. Tpr (142 am.h.) sisaldab kahte leutsiin-zipper regiooni ja see lubab valgul dimeriseeruda. Dimeriseerumine võimaldab kinaasi ahelatel teineteist fosforüleerida, see aktiveerib retseptori, nii käivitataksegi signaali tee ilma ligandita. Tpr-Met valgul ligandi siduvat ekstratsellularset ala ei olegi ja dimeerina esinev kinaas on tsütoplasmas pidevalt aktiivne.
2) Närvikasvu faktori retseptori kinaasne ala on leitud olevat liitunud mitmete valkudega. Isegi NGF retseptori geeni nimetus tuleneb liitvalgust: trk – tropomyosin receptor kinase. Tropo-Trk - NGF retseptori kinaasiga on liitunud tropomüosiini järjestus. Peale selle annab Trk-kinaas liitvalke veel mitme teise valguga. Tpr-Trk - Tpr on liitunud närvi-kasvu-faktori (NGF) retseptori kinaasse ala ette, valk sisaldab ka transmembraanset ala, aga on lokaliseerunud tsütoplasmas ja esineb dimeerina. Erineva pikkusega Tpr-järjestused võivad anda hübriidseid valke, Tpr-Trk1 geen sisaldab 145 bp pikemat Tpr-ala kui Tpr-Met geen. Tpr valk on sarnane laminiinile ja teistele tsütoskeleti ehituses olevatele valkudele, võimaldab oligomeriseerumist. L7-Trk - NGF retseptori geeniga on liitunud ribosomaalse valgu L7 geen.
3) c-ret kodeerib proteiin-türosiin kinaasset retseptorit, mis ekspresseerub varases aregu faasis ja kasvaja kudedes. Nimetus tuleneb sellest, et transformeerunud rakkudes toimuvad tema geenis tihti ümberkorraldused: ret –rearranged during transfection. Tema rakuväline ala on adhesiooni valgu kadheriini taoline. Mutantseid vorme on leitud mitmete haiguste puhul, retseptor on inaktiivne või muutunud aktiivsusega. Mutantsed Ret-retseptorid on iseloomulikud mitmetele pärilikele haigustele. Näiteks, Hirschsprungi haigetel on mutatsioone ret-geeni mitmes kohas ja see geen on inaktiivne. Selle tagajärel ei arene jämesoole neuronid ja neil haigetel puuduvad jämesoole neuronid. Selle geeni mutatsioonidega on seotud mitmed pärilikud kasvajad: MEN 2A ja MEN 2B (multiple endocrine neoplasia) ning FMTC (familial medullary thyroid carcinoma). Nende puhul on kindlad mutatsioonid teada: MEN2A ja FMTC haigel on muteerunud retseptori ekstratsellulaarse ala üks tsüsteiinidest ja retseptor on pidevalt dimeerses olekus, sest üks Cys, mis lubaks tekkida molekuli sisesel C-C-sillal on puudu, ja teine Cys leiab paarilise teises retseptori ahelas. MEN2B haigetel on mutatsioon valgu katalüütilises alas, see muudab kinaasi aktiivsust ja substraadi spetsiifilisust. Selline retseptor on aktiivne ilma dimeriseerumata. Muteerunud retseptorid ei ole enam ligandiga reguleeritavad. Ret-retseptori tsütoplasmaatilisi vorme on leitud türoidsetest kartsinoomidest: p57retPTC , p64ptc1, p81ptc2. Need vormid on pidevalt fosforüleeritud. Nad on tekkinud ret-geeni ja mingi teise geeni liitumise läbi. Ptc tähendab papillary thyroid carcinoma, sellest kasvajast on leitud need hübriidsed valgud, kus retseptori kinaasse domääni N-otsa on liitunud dimeriseerumist soodustav valk. Ret-ga liitvalke on leitud kiiritusega indutseeritud kasvajatest. Türoidsete kasvajate hulk on tõusnud pärast Tš ernobõli katastroofi Valgevene lastel ja nendes kasvajates on leitud palju erinevaid Ret-valgu mutatsioone. ret-geeniga võib olla liitunud ka PKA (proteiinkinaas A) regulaator subühiku geeni osa (saadakse liitvalk RIa -Ret) või mingi zinc-finger proteiini geen (saadakse liitvalk Rfp-Ret). Need muutunud geenid on ainult kasvaja koes, mitte sama inimese tervetes kudedes. Kõigil N-otsa tulnud valkudele on iseloomulik võime moodustada dimeere ja sellega aktiveerida retseptori kinaas. Tegelikult polegi see valk enam retseptor vaid pidevalt aktiivne türosiinkinaas. Taolisi kinaase on leitud mitmetest kasvajatest ja nende normaalsetest ligandidest ei ole sageli midagi teada. Retseptorid, mis muidu ekspresseeruvad embrionaalses arengu faasis, ilmuvad kasvajates. Ret-retseptori ligandiks normaalses koes on GDNF, gliiapärane neurotroofne faktor.
4) Ka PDGFb retseptori valk esineb liitvalguna pidevalt aktiivses vormis: kroonilise müeloidse leukeemia koes on toimunud translokatsioon 5;12, Tel-valgu (üks Ets perekonna transkriptsiooni faktor) N-otsa kodeeriv ala on liitunud PDGFb retseptori türosiin-kinaasset ala kodeeriva järjestusega ja saadakse liitvalk Tel-PDGFb . Tel-valgus on dimeriseerumist võimaldav piirkond ja nii saadakse aktiivne retseptori dimeer.
Onkogeenseid PTK retseptori vorme on leitud paljudest kasvajatest. Alati pole tegemist liitvalguga, aktivatsiooni põhjustavad mutatsioonid. Veel mõned näited mutantsetest retseptor-PT-kinaasidest:
c-cek annab retseptor PTK, mis avaldub embrionaalses arengus. Kasvajatest eraldatud p120cek8 on aktiivne ja fosforüleeritud vormis.
ufo(axl) ekspresseerub kroonilise müeloidse leukeemia haigetel. Rakuline ja onkogeenne vorm on identse valgu järjestusega. 2 erinevat mRNA (3,2 kb ja 4,7 kb) saadakse erinevate polüadenüleerimise kohtade kasutamisega, seega on 3'UTR-s erinevused, see muudab valgu sünteesi taset ja mRNA stabiilsust.
c-fms kodeerib CSF1 retseptorit, ekspresseerub embrionaalses arengus.
v-fms FeSV (feline sarcoma virus) onkovalk, konstitutiivselt aktiivne kinaas, omab mõningaid mutatsioone: mutatsioon C-otsas, või selle otsa deletsioon lõhub ära kinaasi aktivatsiooni negatiivselt reguleeriva ala; Phe asendumine Tyr-969 kohale selles regioonis võimendab kinaasset aktiivsust, aga ei põhjusta konstitutiivse kinaasi teket; mutatsioonid ekstratsellulaarses alas põhjustavad ligandist sõltumatu kinaasi aktivatsiooni ja annavad valgule transformatsiooni võime.
Üks viis rakulisi onkogeene transformeerivaks muuta on nende liitumine retroviirustega. Mõned näited retroviiruse genoomiga liitunud retseptori geenidest:
Rakuline onkogeen c-sea kodeerib retseptor-PTK.
env-sea on lindude erütroblastoosi viiruse (S13 avian erythroblastosis virus) onkogeen, retseptori kinaasi geen on liitunud retroviiruse env geeniga, ekstratsellulaarse ja transmembraanse ala asemel on viiruse valk. Viiruse valgu glükosüleerimine matkib aktiivse retseptori vormi ja kinaas on pidevalt aktiivne.
Järgmises näites on võrreldud retseptor PTK c-Ros ja viiruselise kinaasi v-Ros valgu ehitust ja transformeerimise võimet. c-Ros on retseptor PTK väga suure ekstratsellulaarse alaga, ekspresseerub ainult mõnedes kudedes ja on oluline epiteeli rakkude diferentseerumises embriogeneesis. Ka mõnedes kasvajates on selle ekspressioon kõrge. v-ros on lindude sarkoomi viiruse UR2 transformeeriv onkogeen. Ta kodeerib PTK, mis erineb oma rakulisest homoloogist selle poolest, et geeni 5'-ots on puudu ja selle asemel on viiruse gag-geen; 3 am.h. on lisandunud trasmembraansesse ossa ja C-otsast on 12 am.h. deleteeritud; 3'-otsas on viiruse env-geen. Transformatsiooni võime ja ehituse sõltuvuse uurimisel leiti, et oluline on viiruselise Ros valgu transmembraanne (TM) ala ja selle lähim ümbrus. Kui 7 am.h. transmembraanse ala eest on kadunud, on valk transformeeriv, ka c-Ros muutub sellise mutatsiooniga transformeerivaks. Selles TM ala ees olevas järjestuses on ilmselt negatiivne regulaator, mis ei lase ilma ligandita retseptoril aktiveeruda. Viiruselised gag ja env geenid ei olnud transformatsiooni võimeks olulised. Antud katses olid need geenid viidud plasmiidi koosseisu ja ekspressioon toimus ühe promaatori kontrolli all. In vivo tingimustes retroviirusse liitunud rakuline onkogeen on kaotanud ka oma transkriptsiooni ja translatsiooni reguleerivad alad, see võib tema transformeerivat toimet veelgi tõsta.
Liitvalke retroviiruste valkudega ei anna mitte ainult türosiinkinaassed retseptorid, vaid ka teised. Näiteks, megakariotsüütide kasvu reguleeriva faktori, trombopoietiini (TPO), retseptori homoloog on onkovalk ühes leukeemia viiruses (murine myeloproliferative leukemia virus), v-Mpl. Rakuline valk, c-Mpl, on tüüpiline tsütokiini retseptor, mis aktiveerib JAK2 ja STAT3/STAT5. v-Mpl valgus on osa viiruselisest Env-valgust liitunud TPO retseptori C-otsaga, transmembranse ala lähedal.
Kokkuvõtteks: retseptori onkogeenseks muutumine võib toimuda mutatsioonide, geeni amplifikatsiooni, genoomsete ümberkorralduste ja retroviirustega liitumise läbi.
6. Mitte-retseptor-proteiin-türosiinkinaasid (PTK)
Peale retseptor-kinaaside osalevad signaali ülekandes tsütoplasmaatilised proteiin-türosiin-kinaasid (PTK), mis on rakuliste onkogeenide produktid. Need on jagatud 8 erinevasse rühma: Src perekonnas on 9 liiget, Csk - 2 liiget, Btk - 4, Abl - 2, Fak - 1, Syk - 2, Jak - 4, Fps - 2.
6.1. Src kinaasid
Src-perekonda kuuluvad proteiin-türosiinkinaasid Src, Yes, Yrk, Fyn, Fgr, Blk, Hck, Lyn, Lck. Neist Src, Fyn ja Yes on üldiselt levinud, teised põhiliselt vereloome rakkudes. Src-perekonna kinaasid (53-62 kDa) on membraaniga seotud oma N-otsa kaudu, selleks on vaja 15 esimest am.h. Teises positsioonis olevale glütsiinile pannakse külge müristiinhape (n-tetradekaanhape, CH3-(CH2)12-COOH). Sageli ka palmitüleeritakse Cys10. Müristüleerimine on vajalik eeltingimus palmitüleerimiseks. c-Src valk ei ole palmitüleeritud, kuid ta sisaldab kõrget aluseliste am.h. jääkide osa selles regioonis. Rasvhapetega modifitseeritavale alale järgneb unikaalne variaabel ala: 40-50 am.h. Lyn, Hck, Lck ja Blk valgus; 70 am.h. Src, Yes, Fyn, Yrk ja Fgr valgus. Mõnes valgus on selles alas fosforüleerimise kohad. Src-valgus on Ser17 PKA ja Ser12 PKC substraadid. Selle fosforüleerimise osa regulatsioonis pole teada. Variaabel-alale järgnevad SH3, SH2 ja SH1 alad (Src homoloogia 3, 2 ja 1). SH1 on katalüütilise aktiivsusega, türosiin-kinaas, SH2 seostub fosfo-türosiiniga ja SH3 proliini rikka piirkonnaga. C-otsas on 20 am.h.-line saba, mis sisaldab konserveerunud türosiini. (Tyr527 kana c-Src valgus). Viimane on oluline regulatsioonis. Teda fosforüleerib Csk, Src-valgu C-otsa kinaas. Fosforüleeritud türosiiniga seostub sama valgu SH2 ala ja kinaas on inaktiivne. Normaalne c-Src kinaas ei ole transformeeriv ka üleekspressiooni tingimustes. Tibude sarkoomi viiruse onkogeeni v-src produktis see türosiin puudub (või Tyr527 on asentatud Phe-ga) ja kinaas on pidevalt aktiivne. FSV (feline sarkomi viiruse) valk v-Fgr on ka oma C-otsa alates regulaator-türosiinist kaotanud. Src-perekonna kinaasid võivad rakus üksteist asendada, ühe ära võtmine ei põhjusta alati fenotüübis muutusi. Yes- mutandid ei oma fenotüübis muutusi. Fyn-kinaasi kadumine muudab TCR (T rakkude retseptori) signaali teed tümotsüütides, põhjustab ebanormaalse hippocampuse arengu. Lck puudumine põhjustab tümotsüütide arengu blokeerumise.
Kuidas toimub Src-perekonna valgu aktiveerimine ja onkogeenseks muutmine?
c-Src on ilma aktivaatorita inaktiivne, ta on pakkunud nii, et kinaasne aktiivsus ei avaldu.
On mitu võimalust muuta Src-kinaas pidevalt aktiivseks: C-otsa deletsioon, regulaator-Tyr deletsioon või mutatsioon, Csk kinaasi inaktiveerimine või taseme langus, PTP (proteiin-türosiin-fosfataasi) taseme tõus; SH2 ja SH3 piirkondade deletsioon; mõne teise fosfo-türosiini seostumine SH2-ga või mõne teise valgu SH2 ala seostumine regulaator piirkonna fosfotürosiiniga. Viimased variandid esinevad ka normaalse signaali ülekande puhul. Src, Yes ja Fyn kinaaside aktiivsus suureneb nende seostumisel aktiveeritud PDGF või CSF-1 retseptoriga. Ka fosforüleeritud peptiidid suurendavad Src kinaasset aktiivsust, kuna nad seovad tema SH2-alaga. Lck kinaasi aktivatsioonis on oluline fosfataasi aktiveerimine, aktiveeritakse PTP CD45. See fosfataas on vajalik signaali teeks üle Lck. Ka sellise fosfataasi üle-ekspressioon võib Src kinaase aktiveerida. Kui fosfataasid on signaali ahelas üldiselt aktiveeritud oleku maha võtjad, siis Src kinaaside C-otsa defosforüleerivad ensüümid on kinaasi aktiveerijad. Signaali tee võib alata mitte kinaasi aktiveerimisega, vaid fosfataasi aktiveerimisega.
Kui Src valgus on muteerunud kinaasne domään ja kinaasset aktiivsust ei ole, siis käitub valk dominant-negatiivse mutandina, supresseerib signaali tee: seostudes aktiveeritud retseptoriga blokeerib selle, ise signaali edasi ei anna ja teist valku retseptoriga seostuma ei lase.
6.2. Csk kinaasid
Csk - carboxy-terminal Src kinase – proteiin-türosiinkinaaside perekond. 50 kDa-lised valgud, mis fosforüleerivad Src-valgu C-otsa türosiini. Nad ei ole müristuleeritud ja ei oma fosforüleeritavat Tyr katalüütilises alas ega C-otsas. Nendel on SH3 ja SH2 vaheline ala 6 am.h. võrra pikem kui Src ja Abl kinaasidel. Csk cDNA on kloneeritud rotist, tibust, hiirest, inimesest ja on kõrgelt konserveerunud (90%). Src-kinaasidega on homoloogia 40-45%. Csk ekspresseerub kõigis kudedes ja on lokaliseerunud tsütoplasmas. c-csk geeni lõhkumine hiires põhjustas loote surma, mutantse embrio rakkudes oli Src kinaasi aktiivsus 10x kõrgem, C-otsa Tyr oli vähe fosforüleeritud. On leitud veel teisi Csk sarnaseid kinaase: Matk (megakaryocyte-associated tyrosine kinase), Hyl (hematopoietic consensus tyrosine lacking kinase), Lsk (leukocyte carboxyl-terminal src kinase) inimesest. Täpsem analüüs näitas, et need on ühe geeni produktid. Nii et inimesel on kaks seda tüüpi kinaasi – Csk ja Lsk. Ka hiirest on kloneeritud analoogne kinaas Ctk (Csk-type protein tyrosin kinase) ja Ntk (nervous tissue and T-lymphocyte kinase) nime all. Need Csk sarnased kinaasid ekspresseeruvad koe spetsiifiliselt. Csk kinaasi SH3 domään on erinev Src kinaasi analoogsest domäänist ja SH2 domään ei reguleeri ensüümi enda aktiivsust. Need alad on olulised valk-valk interaktsioonideks, aga mitte ensümaatiliseks aktiivsuseks. Csk kinaaside osa onkogeneesis seisab selles, et tema madal tase tõstab Src kinaaside aktiivsust ja võib muuta selle onkogeenseks.
6.3. Btk kinaasid
Need 92 kDa-lised proteiin-türosiinkinaasid on leitud inimese ja hiire rakkudest nimetustega Atk või Btk, Tec I ja II, Itk või Tsk. Ei ole müristüleeritavad ega oma COOH-otsas fosforüleeritavat Tyr. Sisaldavad peale SH1, SH2 ja SH3 ala veel PH (pleckstrin homology) piirkonda. See on N-otsas müristüleerimise kohtade asemel. PH on 100 am.h.-line domään, mis seob inositool-lipiide ja fosforüleeritud inositooliga lipiide. Btk valgu PH ala seob spetsiifiliselt PI(3,4,5)P3 ja vahendab valgu sidumist membraanile. Mutatsioonid btk geenis on seotud X-liitelise agammaglobuliin-aneemiaga (XLA), Btk nimetus tähendas Bruton's tyrosine kinase, inimese järgi, kes esimesena mainis seda haigust. Nii inimeses kui hiires btk geeni lõhkumine mõjub B rakkude arengule. Btk ekspresseerub B rakkudes ja müeloidsetes rakkudes aga mitte T rakkudes. Itk ekspresseerub ainult T rakkudes, Tec kinaasid ekspresseeruvad kas maksas või vereloome rakkudes. Tec ekspressiooni on leitud IL3 sõltuvates müeloidse leukeemia rakkudes, kus valku toodetakse mitmelt erinevalt mRNA-lt, saadakse mõningate muutustega valgud: N-otsas on 13 am.h. asendatud 94 am.h.-ga, või on insertsioon toonud 22 am.h. SH3 ala juurde lisaks, või on valgu C-otsas 27 am.h. asendatud 21 uue am.h.-ga.
Selle rühma kinaasidega on sarnased Fps/Fes kinaasid. Nad on ka iseloomulikud müeloidsetele rakkudele, seostuvad mõnede retseptoritega (GM-CSF retseptoriga).
6.4. Abl kinaasid
Abl kinaas kirjeldati algselt kui Abelson murine leukemia viiruse onkovalk. Tema rakuline homoloog on 145 kDa-line proteiin-türosiinkinaas. Sarnaselt Src kinaasidega sisaldab SH1, SH2 ja SH3 alasid. Peale selle on neil pikk C-terminaalne ala, 600 am.h., mis sisaldab tuuma-lokalisatsiooni signaali, DNA-sidumise ala, aktiiniga sidumise ala ja proliini rikast piirkonda, ei sisalda fosforüleeritavat türosiini. Siia rühma kuulub 2 kinaasi: Abl ja Arg (abl-related gene). Nad on mõlemad kõigis kudedes ekspresseeruvad ja neid toodetakse kahelt erinevalt mRNA-lt, mis erinevad oma 5'exoni poolest. Seega saadakse kahte tüüpi valke: müristüleeritud ja mitte-müristüleeritud vormid. Mõlemad on lokaliseerunud nii tuumas kui ka tsütoplasmas. On leitud, et c-Abl on raku tuumas kasvu inhibiitor ja tema kinaasne aktiivsus käivitatakse vigastatud DNA poolt. Src ja Abl-kinaasid erinevad selle poolest, et Abl lokaliseerub ka tuumas ja tema kinaasne domään võib siduda Rb-valku. c-Abl negatiivseks regulatsiooniks in vivo on oluline SH3 ala ja COOH-otsa regulaator-ala. Abl-valgu regulatsioonis vajatakse ka mingeid rakulisi fakoreid. Üheks selliseks on pakutud Pag-valku. Erinevalt v-Abl-st c-Abl ei ole transformeeriv isegi mõõduka üle-ekspressiooni tingimustes. Normalselt on c-Abl aktiivsus supresseeritud. Seda supressiooni saab kõrvaldada regulaator-piirkondade deletsioonidega või mutatsioonidega. SH3 ala deletsioon annab pidevalt aktiivse kinaasi. COOH-ots nii Abl kui Arg valgus sisaldab negatiivses regulatsioonis vajalikku proliini-rikast ala, selle deleteerimine annab aktiivse kinaasi. SH2 ala on absoluutselt vajalik Abl transformeeriva toime jaoks, kuid mehhanism pole teada, tema asukoht võib olla muutunud ja ta võib olla asendunud mõne teise valgu SH2-ga. Abl omab ka autofosforüleeritavat türosiini (Tyr412), kuid tema osa regulatsioonis pole teada.
Retroviirustest omavad abl geeni Abelson murine leukemia virus (AMuLV), Hardy-Zuckerman-II feline sarcoma virus (HZ II-FSV). Viiruselised onkovalgud on liitvalgud viiruse valguga Gag. Viiruses on abl geeni ees gag geen ja saadav liitvalk – hiire viirusest (murine v-Abl,) 160 kDa - on transformeeriv. Selles on Abl-valgust N-ots koos SH3 alaga kadunud. Viiruses võib Abl kinaasne domään olla ka gag ja pol geeni vahel, nii on FSV v- Abl liitvalk (110 kDa), kus Gag ja Pol- valgu vahel on Abl, mis on kaotanud suure osa oma C-otsast. Ka see viiruseline Abl on transformeeriv. Mõlemad viiruselised Abl valgud on lokaliseeritud tsütoplasmas ja on aktiivsed PTK.
Ebanormaalseid Abl valke on leitud ka leukeemia haigetel. Nii kroonilise müeloidse leukeemia (chronic myelogenous leukemia, CML) kui ägeda lümfoidse leukeemia (acute lymphocytic leukemia, ALL) haigetele on iseloomulik Bcr-Abl valk. CML puhul on iseloomulik 210 kDa ja ALL puhul 185 kDa Bcr-Abl valk. Siin on abl geeni ette liitunud bcr-järjestus. Abl on 9. kromosoomis ja Bcr 22. kromosoomis, translokatsiooni tagajärel on tekkinud Philadelphia (Ph) kromosoom, kus on liitunud abl geeni 3' osa (9q34-st) ja bcr geeni 5' osa (22q11-st). Saadakse valk, millel N-otsas on Bcr-järjestus. CML haigetel on 927 või 907 am.h. liitunud Abl SH3 ala ette. ALL haigetel aga 426 am. h., kas sellel erinevusel on ka haigusele mingi tähendus, pole teada. On leitud, et Bcr-Abl liitvalk, mis sisaldab ainult 1.-191. aminohapet Bcr-valgust, on transformatsiooni võimeline. Aminohapete 192.-923 lisamine ei mõju transformatsioonile. Bcr ise on mitut aktiivsust omav valk. Ta arvatakse olevat Ser/Thr proteiinkinaas, ATP siduv ala jääb vahemikku 250.-400 am.h. Peale selle on tal Rac/Rho-valkudega seostuvad aktiivsused (Dbl ja GAP). Bcr-järjestus võimaldab Bcr-Abl liitvalgul dimeriseeruda, Abl valgu proteiin-türosiinkinaasne domään on vaba ja ensüüm on aktiivne. Bcr-Abl sisaldab nii SH2, SH3, SH1 kui ka COOH-otsa proliini rikast ala Abl-valgust, kuid on pidevalt aktiivne, lokaliseerub tsütoplasmas, kinnitub aktiini filamentidele. Bcr valgu N-ots on vajalik valgu transformatsiooni võimeks, kui deleteerida bcr 1.ekson, on valgu oligomeriseerumine takistatud ja samuti transformatsioon Bcr-Abl-ga. Bcr-Abl võib anda nii homodimeere kui ka dimeere Bcr-ga, fosforüleeritakse Tyr 177 Bcr-is. See fosforüleerimine on vajalik transformeerimiseks Bcr-Abl-ga, see lubab Bcr-Abl seostumise SH2-sisaldavate valkudega, adapter-valkudega, mis viivad Bcr-Abl kompleksi signaalitee teiste valkudega.
Abl-kinaasi aktiveerimine deletsioonidega ja liitvalgu moodustumine Bcr-ga on pildil.
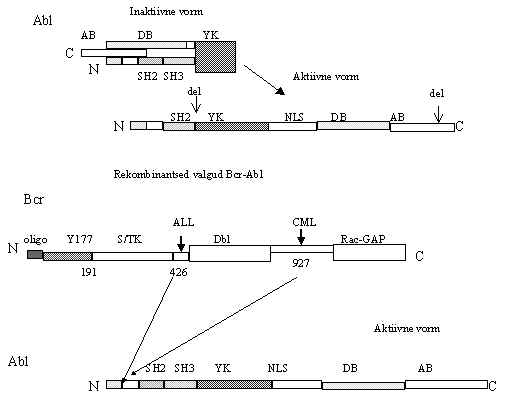
Abl-kinaas võib anda ka teisi liitvalke. Akuutse müeloidse leukeemia rakkudes on translokatsioon t(12;9) põhjustanud Tel-Abl liitvalgu tekkimise, kus Abl-valgu N-otsa on tulnud ühe transkriptsiooni faktori Tel dimeriseerumist soodustav ala.
Muteerunud Abl kinaase toodetakse ainult haigetes kudedes, mitte sama inimese tervetes kudedes. Kas põhjustab haigus mutatsioonide teket või muutunud Abl haiguse, pole teada. Kuid tsütoplasmas olev ja pidevalt aktiivne Abl-kinaas osaleb signaali ülekandes ning aktiveerib rakkude kasvu. Nii viiruselised kui haigest koest eraldatud Abl geenid on võimelised teistes rakkudes kasvajalisi muutusi esile kutsuma.
6.5. Tsütoplasmaatilised kinaasid ja viiruselised onkovalgud
Peale selle, et tsütoplasmaatilised PTK võivad ise olla transformeerivad, võvad nad muutuda transformeerivateks koos mitmete viiruseliste onkovalkudega. Tsütoplasmaatilisi PTK aktiveerivad mitmed viiruselised onkovalgud: hiire ja hamstri polüoomi viiruse transformeerivad valgud, herpese viiruste EBV valk LMP2A ja herpes virus saimiri valk Tip. Sealjuures toimivad hiire ja hamstri polüoomi viiruse valgud erinevatele Src-perekonna kinaasidele ja onkovalgud seostuvad erinevate osadega aktiveeritud kinaasis. Ka erinevate herpese viiruste valgud seostuvad erinevate aladega kinaasides. Src-perekonna kinaasidega seostuvad ka mõned retroviiruste valgud. Eelpool nimetatud viiruseliste onkovalkude toime seisab põhiliselt selles, et nad stabiliseerivad kinaasi aktiveeritud vormi, ei lase tal inaktiivsesse olekusse tagasi minna. Sellega tõstavad rakus türosiin-kinaasset aktiivsust.
7. Adapter-valgud kui onkovalgud
Tsütoplasmaatilised PTK, mis on oma kinaasse domääni kaotanud - selliselt kirjeldati 1990. aastal väikseid valke, mis omasid SH2 ja SH3 järjestusi ja mis seostusid aktiveeritud retseptoriga ning mille geenid võisid olla ka transformeerivateks onkogeenideks. Hiljem on hakatud neid nimetama adapter-valkudeks. Adapter-valgud osalevad valgukomplekside tekitamisel. Selliseid valke on kirjeldatud juba mitmeid, paljud neist osalevad signaali ülekande kompleksi moodustamisel ja on üleekspressiooni tingimustes rakke transformeerivad. Järgnevalt iseloomustame neist mõningaid, mis on osalised signaali ülekande kompleksides.
Shc - SH2 domääni ja collageenile sarnast glütsiini ja proliini rikast ala kandev väike valk. On teada mitu vormi: p46, p52, p66 on ära tuntavad Shc antikehaga paljudes loomsetes rakuliinides. Valk p66 sisaldab unikaalset N-otsa, mis on ka glütsiini ja proliini rikas (CH2-domään), ei avaldu kõigis raku tüüpides. Shc ei oma mingit ensümaatilist aktiivsust. Sisaldab P-Tyr sidumise kohti PTB ja SH2, on fosforüleeritav Tyr jäägist. Shc seostub PDGFb retseptori fosforüleeritud Tyr579, Tyr740, Tyr751 ja Tyr771-ga. PDGF ja EGF retseptori aktiveerimisel Shc fosforüleeritakse. Shc valk võib rakke transformeerida: kõrge Shc tase hiire fibroblastides NIH3T3 põhjustab rakkude transformatsiooni. Shc üleekspressioon rakus suurendab MAP kinaasi aktiivsust ja rakkude kasvu. Shc võib olla retseptori aktiveerimisel esimeseks signaali vastuvõtjaks ja signaali ülekande kompleksi moodustajaks, on näidatud tema seostumine ühe teise adapter-valguga Grb2. Shc on transformeeriv onkovalk. Erinevalt p46/p52 valkudest p66 ei transformeeri fibroblaste rakukultuuris, ta ei aktiveeri MAP kinaase ja inhibeerib Fos ekspressiooni. Shc-valgu p66 N-ots omab inhibeerivat toimet Shc-valgu transformatsiooni võimele.
Nck - 45 kDa suurune valk, sisaldab ühe SH2 ja kolm SH3 domääni. On fosforüleeritav Tyr, Ser ja Thr kohalt. Nck seostub PDGFb ahelaga P-Tyr751 kaudu. Nck üleekspressioon põhjustab transformatsiooni. On leitud, et Nck oma SH3 alaga seostub PAK1-ga, s.o. Cdc42 ja Rac-aktiveeritava kinaasiga. Nck-PAK1 komlpeks võib SH2 ala abil seostuda aktiveeritud retseptoriga, see suurendab PAK1 aktiivsust, PAK1 osaleb JNK ja MAPK aktivatsioonil.
Shb - väike adapter-valk, sisaldab ühe SH2 ala COOH-otsas ja mitu proliini rikast ala N-otsas. mRNA-s on mitu translatsiooni alguspunkti ja saadakse erineva proliini sisaldusega valgud p56, p67. Shb seostub paljude P-Tyr-ga PDGFb retseptoris. Shb ei sisalda türosiini fosforüleerimise kohti ja tema transformatsiooni võimet pole näidatud.
Grb2 - growth factor receptor-bound protein 2, p23, sisaldab ühe SH2 ala ja kaks SH3 ala, N-otsa SH3 ja C-otsa SH3. Seob EGF ja PDGF retseptori fosfotürosiinidega. Grb2 on homoloogne C.elegans'i valguga Sem-5 ja Drosophila valguga Drk. Nii nematoodis kui ka Drosophilas selle valgu puudumine on letaalne. On näidatud, et Grb2 on kompleksis mSos valguga, mis on Ras valgu aktiveerija, G nukleotiidi vahetaja. Grb2 moodustab kompleksi ka valguga p140, see on üks vereloome rakkudes ekspresseeruv P-Tyr sisaldav valk. Interleukiin 3 stimuleeritud rakuliinis on kirjeldatud oligomeerne kompleks: fosforüleeritud retseptor (GM-CSFr)+ Shc-P + Grb2 + mSos ja p140 võib ka selles kompleksis olla. Granulotsüütide-makrofaagide kolooniaid stimuleeriva faktori ja IL3 retseptor ei ole PTK, nad aktiveerivad tsütoplasmaatilise kinaasi Fps. Shc fosforüleerimine moodustab Grb2-Sos sidumise koha ja Sos aktiveerib Ras valgu. Grb2 üksi ei ole transformeeriv, küll aga koos Shc-ga, Shc on selles kompleksis limiteeriv. Kui Grb2 on kaotanud oma SH2 domääni, muutub ta dominant negatiivseks, korjab enda külge mSos ja p140 aga signaali ahelas ei osale.
Crk - sisaldab ühe SH2 ala ja kaks SH3 ala, on fosforüleeritav Tyr kohalt. Crk üleekspressioon on rakke transformeeriv.
v-Crk - lindude sarkoomi viiruse CT10 onkovalk p47gag-crk , transformeerib tibu embrüo fibroblaste. v-Crk tekib rakulise Crk valgu ja viiruse gag geeni produkti liitumisel. v-Crk sisaldab ainult ühte SH2 ala ja ühte SH3 ala, teine SH3 ala COOH-otsas on ära lõigatud. v-Crk ekspressioon rakus tõstab paljudes valkudes türosiini fosforüleeritust (p130, p110, p70). v-Crk seob oma SH2-ga P-Tyr sisaldavaid valke, osaleb sellega signaali ülekande kompleksi tekkimisel. Kui SH2 ala on deleteeritud, siis v-Crk ei ole enam transformatsiooni võimeline. Crk moodustab samu komplekse, mis Grb2, aga P-Tyr järjestus-spetsiifika ja sidumise affiinsus on teine.
8. Ras valgud ja onkogenees
8.1. Ras valgu ehitus ja aktivatsioon
Ras valgud kuuluvad GTPaaside hulka, neid nimetatakse ka väikesteks G-valkudeks. Nad on monomeersed 21-29 kDa suurused GTP ja GDP siduvad valgud. GTP-ga seotult on ta signaali ahelas aktiivne ja GDP-ga seotult inaktiivne. Ras valgud on nõrgad GTPaasid, kkat.GTP on < 0,03 min-1. GTP hüdrolüüsi käivitamiseks vajavad nad abivalke GAP (GTPase activating proteins). GAP valgud kiirendavad GTP-ga seotud Ras valgu muutumist GDP-seotud vormi, s.t. suurendavad inaktiivse Ras hulka. GTP ja GDT sidumise konstandid on lähedased, kuna rakus on GDP kontsentratsioon > 10-5M ja GTP > 10-4M, siis vaba Ras seob GTP. Limiteeriv on GDP vabanemine Ras valgust. Ka selle protsessi jaoks on aktivaatorid, nad esinevad kirjanduses mitme nime all: GEF (G exchange factors), GDS (GDP dissotsiatsiooni stimulaatorid), GNRP (GDP-releasing proteins), GRF (releasing factors). Ras abivalkude hulka kuulub ka GDI, mis inhibeerib nukleotiidi dissotsiatsiooni ja GTPaasi.
Ras valku on üsna põhjalikult uuritud, on teada struktuur ja paljud funktsionaalsed domäänid. Eritatakse 5 olulist piirkonda, mis on konserveerunud kõigis Ras perekonna valkudes:
G-1 regioon hõlmab 10. - 17. am.h.: GXGXXGKS/T. See ala võtab osa GTP a ja b fosfaadi sidumisest. Oluline GTP hüdrolüüsiks on Gly12. Kui Gly asendada Val-ga, kaob GTP-aasne võime ja saadakse pidevalt aktiivses vormis olev mutant V12H-Ras. Mutant N17H-Ras (asparagiin 17 on Ser või Thr asemel) on alati GDP-ga seotud vormis, ei lase GDP lahkuda ega seo GTP. See on dominant negatiivne Ras'i mutant, ta ei luba normaalset Ras aktiveerida, kuna seob endaga aktiveerivad faktorid, aga ise ei aktiveeru.
G-2 regioon moodustub 32. - 40. am.h., selles osas toimub konformatsiooni muutus kui GDP vahetub GTP-ga. See ala on kõrgelt konserveerunud kõigis GTPaasides. Konformatsiooni muutuses on eriti olulised Thr35, Gly60 ja Gln61.
G-3 regioon, 53. - 62. am.h., seob GTP g fosfaati, ka see on konserveerunud järjestus. Gln61 asendamine 17 erineva aminohappega tekitab transformeeriva Ras valgu. Regioonide G-2 ja G-3 kaudu toimib GAP valk. Mutatsioonid nendes alades muudavad Ras valgu GAP'le tundetuks ja valk on pidevalt GTP-ga seotud aktiivses vormis. Selliseid mutatsioone on leitud mitmetest kasvajatest. Sageli on muteerunud ka 12. positsioon, mis annab pidevalt aktiivses vormis oleva Ras-valgu .
G-4 regioon, 112. - 119. am.h., sisaldab hüdrofoobseid am.h. ja osaleb guaniini ringi sidumises.
G-5 regioon, 144. - 146. am.h., osaleb ka guaniini ringi sidumises ja on loomsetes organismides konserveerunud.
G-4 ja G-5 regioonis toimunud mutatsioonid muudavad valgu affiinsust guaniini suhtes. Kui nad võimaldavad GDP-st kergemini vabaneda, tõstavad nad GTP-ga seotud vormi taset, sellised mutatsioonid on leitud kasvajatest. Selle piirkonna kaudu toimivad GDP vabastavad faktorid.
Ras valgule on iseloomulik COOH-otsa modifitseerimine, isoprenüleeritakse või farnesüleeritakse, metüleeritakse ja palmitüleeritakse. Nende modifikatsioonide abil seostub valk membraaniga. Aktiivse Ras valgu saamisel on seega tähtis ka modifitseerivate ensüümide olemasolu ja tase rakus. Kui Ras ei ole farnesüleeritud, siis teda ka ei palmitüleerita. Aktiivse Ras saamiseks on oluline farnesüleerimine. Näiteks farnesüül-transferaasi inhibeerimisega on saadud blokeerida onkogeense Ras-valgu rakke transformeeriv toime. Farnesüültransferaasi inhibiitoriks võivad olla Ras-valgu C-otsa CAAX matkivad peptiidid.
8.2. Ras-perekonna valkude abivalgud
Ras-perekonna valgud signaali ülekande ahelas ei tööta ilma abistajateta. Suhteliselt väkesed Ras valgud (190 am.h.) kasutavad aktivaatoreid, mis on nendest 10-15x suuremad. Ras toime sõltub paljudest teistest valkudest rakus. Ühed suurendavad Ras-GTP vormi hulka vabastades teda GDP-st, teised alandavad Ras-GTP taset aktiveerides tema GTP-aasset võimet.
GTP-aasi aktivaatorid (GAP) Ras jaoks on p120GAP, NF1. Viimane on neurofibromin 1, see 220 kDa-line valk on mõnedes närvikoe kasvajates defektne või puudub hoopis. Arvatakse, et selle puudumine põhjustab neurofibromatoosi. Viimase aja uurimised on näidanud, et neurofibromatoosi haigetel on Ras-GTP tase kõrgem, kui normaalsetel kudedel. GTPaasi aktivaatorite puudumisel on Ras valk pikemalt aktiivses vormis ja osaleb signaali edastamisel. NF1-l arvatakse olevat veel ka teisi toimeid, ta pärsib ka selliste Ras-valkude transformeerivat võimet, mis ei omagi GTP-aasset aktiivsust. NF1 blokeerib signaali tee Ras-lt. Võibolla takistades teise valgu sidumist. GAP p120 sisaldab hüdrofoobset piirkonda, SH2 ja SH3 alasid, PH ala, fosfolipiide siduvat ala, mis osaleb membraaniga kontaktides. GTPaasi stimulaator-järjestus on 250 am.h., sellega seob ta Ras-ga. See valk võib seostuda oma SH2 abil aktiveeritud retseptoriga ja viia Ras valgu signaali ülekande kompleksi. GTPaasi aktivaatorid alandavad aktiivses vormis oleva G valgu taset, võtavad signaali maha. Nende puudumine või defektid nendes võivad viia rakud transformatsiooni teele.
GDP vabastavad faktorid (GRF ehk GEF) Ras jaoks on rasGRF ja MmSos1. Peale spetsiifilise Ras-ga sidumise domääni sisaldavad need valgud ka teisi valk-valk kontakte võimaldavaid järjestusi: PH, proliini rikas ala ja rho/rac GEF, mis seostub teiste GTP-aasidega Rho ja Rac. Ras-valgu vahendatud signaali tees ei ole ainult Raf-le minev haru, vaid Ras-lt läheb signaal mitmele teele, aktiveeritakse teised GTP-aasid. Ühenduslüliks nende vahel võivad olla Ras-perekonna valkude abivalgud, GDP vabastavad faktorid.
Rho/Rac GTPaasi aktivaatoriks on valgud p50Rho/GAP, Bcr, Abr, p190GAP ja PI3-kinaasi regulaator-subühik p85. Nad sisaldavad 140 aminohappelist GAP-ala, mis ei ole eriti sarnane Ras-valgu GAP-alaga. Mõned GAPd on spetsiifilised ainult Rac’le (chimerin) või Rho’le (p122), teised on laiema spetsiifikaga. On näidatud Ras-GAPi p120 ja Rho-GAPi p190 omavaheline interaktsioon, mis võib olla oluline kahe GTP-aasi Ras ja Rho akivatsiooni koordineerimisel.
Rho ja Rac-valkude GDP vabastavad faktorid on Dbl perekonna valgud. Dbl, esimene seda tüüpi valk, sai oma nime kasvajast, kust teda eraldati - inimese difuusne B-rakkude lümfoom. Dbl onkogeensus NIH-3T3 rakkudes näidati juba 1985.a., selle valgu järgi on saanud nime kogu see valkude rühm. Dbl homoloogia (DH, 180-aminohappet) on kõigis Rho/Rac GDP vabastavates faktorites. Peale selle on kõigis Dbl-valkudes pleksitriini homoloogia (PH). Kui üles lugeda seni teada olevad kõik Rho/Rac’ile sobivad vahetusfaktorid, saab üsna pika rea: Dbl, Lbc, Lfc, Lsc, Net1, Ost, Dbs, Tiam-1, Bcr, Abr, Sos1, Sos2, RasGRF, RasGFR2, Vav, Vav2, Ect2, Tim, Fgd1, Trio, RhoGEF, Kalirin. Paljud neist on leitud olevat transformeerivad onkovalgud. Mõned neist omavad ka GAP-aktiivsust. Vav (leitud vereloome rakkudest) sisaldab SH2 ja SH3 alasid ning fosfolipiide siduvat järjestust. Bcr sisaldab peale GDP vabastava aktiivsuse ka GTPaasi aktiveerivat aktiivsust ja Ser/Thr proteiin-kinaasset aktiivsust. Bcr võib olla osaliselt lülitunud Abl kinaasi koosseisu ja aktiveerib seda, pikem Bcr-Abl hübriid sisaldab Dbl homoloogiat, s.t. GDP vabastavat aktiivsust; lühem seda ei sisalda. Lühem Bcr on iseloomulik ägedamale haiguse vormile. Kas Bcr-Abl seostumine Rho/Rac valkudega mõjutab kuidagi haiguse kulgu, pole teada. GTPaasi aktiveeriv võime aga puudub Abl-ga liitunud Bcr osal mõlemal juhul. Rho/Rac valke aktiveerib ka onkogeeni ect2 produkt. See ekspresseerub maksas, neerus, põrnas, testises. Selle ekspressioon NIH/3T3 rakkudes põhjustab transformatsiooni.
Ras abivalkude hulka kuuluvad ka guaniin-nukleotiidi dissotsiatsiooni inhibiitorid (GDI). GDI on kirjeldatud Rho/Rac valkudele. RhoGDI seob GDP-ga kompleksis olevaid RhoA ja RhoB valke ja inhibeerib GDP lahkumist. GTP-Rho võib ka GDI siduda ja siis on inhibeeritud GAP-stimuleeritud GTPaas. RhoGDI on oluline Rho-valkude liikumisele membraani ja tsütoplasma vahel. Puhkavates rakkudes on Rho-valgud tsütosoolis kompleksis GDI-ga ja on inaktiivsed. Raku aktiveerimisel Rho vabaneb GDI-st ja liigub membraanile.
Ras perekond on suur valkude perekond, abivalgud toimivad sageli mitmele Ras perekonna valgule või kontakteeruvad teiste abivalkudega ja võivad viia erinevaid Ras valke kompleksi, koordineerida nende tööd. Tekib GTPaaside kaskaad.
8.3. Ras perekonna valgud
Nagu paljud onkogeenid, kirjeldati ka Ras valk algselt viirustes. 1980-ndatel aastatel leiti, et Harvey, BALB, Rasheed murine sarkoomi viirused (Ha-MuSV, BALB-MuSV, Rasheed-MuSV) kannavad transformeerivat valku v-H-Ras, Kirsten sarkoomi viiruses (Ki-MuSV) on v-K-Ras, inimese neuroblastoomist leiti v-N-Ras. (Harvey, Rasheed ja Kirsten on inimeste nimed, kes neid viirusi kirjeldasid, ja BALB on hiire liin, milles viirust prooviti).
1990-ndatel aastatel oli juba teada 50 erinevat Ras valku ja 1998 a. andmetel juba 80 erinevat loomset väikest G-valku, molekulkaaluga 20-29 kDa. Ras perekonna valgud on jagatud alaperekondadeks Ras, Rap, Rab, Ral, Rho, Ran, Rhed, Rad/Gem, Rin/Rit, Arf jt. Võib oletada nende valkude seost kasvajatega, 40% kasvajatest on Ras muteerunud. Inimesel on kolm erinevat ras geeni, millelt toodetakse nelja valku: H-Ras, N-Ras, K-Ras A ja K-Ras B. K-ras geenis on kaks erinevat 4. eksonit ja toodetakse kahte erinevat valku, K-Ras B valgus ei ole Cys palmitüleerimiseks, ta sisaldab 6-lüsiinilist järjestust, mis lubab tal seostuda membraaniga. H-, N- ja K-Ras valgus on 85 esimest aminohapet identsed, siis 85% homoloogiaga ala ja lõpus on variaabel ala, päris lõpus on veel modifitseerimise kohad. Kas erinevad Ras valgud omavad erinevaid bioloogilisi funktsioone pole täpselt teada. Kuid arvata võib, et funktsioonid on erinevad. On leitud, et variaabel ala, mis on omane ühele Ras tüübile, on tugevalt konserveerunud erinevate imetajate seas. Kuigi kolm ras geeni ekspresseeruvad kõikjal inimeses, on kudede vahel ja arenguliselt erinevus ekspressiooni tasemes. Erinevast koest kasvajad sisaldavad erineva sagedusega Ras valkude mutatsioone: müeloidses leukeemias on 70% mutatsioone N-Ras valgus; põie kasvajates on ainult H-Ras mutatsioonid; pankrease adenokartsinoom sisaldab 75% juhtudel K-Ras mutatsioone. Ka transformatsiooni võime avaldub erinevates kudedes erinevalt, mõnes on H-Ras transformeeriv, teises jälle K-Ras. Normaalne Ras valk võib üleekspressiooni puhul olla transformeeriv, kuid viiruselised ja muteerunud vormid on efektiivsemad.
Mitte-transformeeriv on R-Ras, ta on 55% ulatuses identne H-Ras-ga, seostub oma C-otsaga Bcl 2 valguga, viimane osaleb apoptoosi regulatsioonis.
Rap valgud kuuluvad eraldi alarühmana Ras valkude hulka. Rap A1 võib blokeerida onkogeense K-Ras toime, ta seostub Raf valguga ja ei lase sel siduda aktiivse Ras-ga.
Rap1 aktiveeritakse paljude stimulaatorite poolt, sealhulgas ka DAG, Ca-ioonid ja cAMP. Viimased andmed näitavad, et cAMP aktiveerib Rap valgu vahetusfaktori Epac (exchange protein directly activated by cAMP) kaudu, ilma PKA osaluseta. Epac seob cAMP in vitro ja omab G-nukleotiidi vahetavat aktiivsust Rap1 jaoks.
Rho valgud on ka Ras perekonna GTPaasid. Siia alarühma kuulub 14 liiget: RhoA, B, C, D, G ja E/Rnd3/Rho8, Rnd1/Rho6, Rnd2/Rho7; Rac 1, 2, 3; CDC42H/CDC42P ja TC10 ning TTF. Need on kirjeldatud imetajatel. Neil on omavaheline 50%-ne homoloogia ja 30% ulatuses on nad sarnased teiste Ras valkudega. RhoA, RhoB, RhoC osalevad tsütoskeleti muutustes. Rakkude stimuleerimisel näiteks lüsofosfatidüülhappega või Rho valgu sisse viimisel tekivad aktiini kiud. Selles protsessis osalevad ka mitmed kinaasid. On kirjeldatud Rho-GTP vormiga seostuvaid ja aktiveeritavaid Ser/Thr kinaase ROK. Just need osalevad nn. stressi kiudude tekkimisel. Rho-valgu jaoks on teada üle 20 GDP vahetava faktori ja 16 GTPaasi aktivaatorit. Rho-valkude alarühma kuuluvad Rac valgud Rac 1 ja Rac 2 osalevad membraani liikumise indutseerimises ja membraansete NADPH oksidaaside aktivatsioonis koos tsütoplasmaatiliste valkudega p47 ning p67. rac1 geen ekspresseerub paljudes kudedes ja rakuliinides, rac2 ekspressioon piirdub vereloome rakkudega. Rac ja Cdc42-GTP vormidega seostuvad türosiin-kinaasid ACK (aktiveeritud Cdc42-ga seostuv kinaas) ja PYK (proliini rikas türosiin-kinaas); samuti Ser/Thr kinaasid PAK (p21,Cdc42/Rac-aktiveeritud kinaas). Rho ja Rac-valgu aktiivsed vormid aktiveerivad ka lipiidide kinaase: fosfatidüül-inositool-3-kinaasi ja fosfatidüül-inositool-5-kinaasi. Rho ja Rac valkude aktivatsioon põhjustab raku morfoloogilisi muutusi.
Rab valgud on rakusiseses transpordis osalevad GTPaasid.
Ran valgud on tuuma GTPaasid.
Kõik need valgud osalevad onkogeneesis, kuidas nad seda teevad, pole teada. Küll aga on teada mutantseid valke, mis võivad transformeerida: V12Rac 1 on Rac 1 valgu mutant, mis on pidevalt aktiivses vormis ja põhjustab rakkude transformatsiooni analoogselt pidevalt atiivse Ras mutandiga V12H-Ras; N17Rac on analoogselt N17Ras-ile dominant-negatiivne, pidurdab transformatsiooni. Kuid ta teeb seda siis, kui transformeeriv valk on Ras, kuid onkogeense Raf-valgu toimet ta ei inhibeeri, ilmselt mõjutab Rac signaali teed ülalpool Raf-valku. V14Rho A on pidevalt aktiivses vormis olev Rho-valk, transformeerib rakke kui ekspresseeruvad ka Ras ja Raf valgud; N19RhoA on Rho valgu dominant negatiivne mutant, inhibeerib V12H-Ras ja RafCAAX transformeeriva toime. V12H-Ras ja RafCAAX on mutantsed transformeerivad Ras ja Raf vormid. Nii onkogeensete kui transformatsiooni inhibeerivate mutantsete Rac ja Rho vormide olemasolu viitab sellele, et need valgud on olulised onkogeneesis. Nii Rac-valk kui Rho-valgu onkogeenne GEF (Dbl, Vav) aktiveerivad JNK, mis fosforüleerib Jun-valku. Rac ja Rho aktiveerivad NFk B üle reaktiivsete hapniku ühendite. Raku kasvu käivitamiseks või muutmiseks on vaja Ras, Rho ja Rac valkude koordineeritud tegevust. Neilt läheb signaal transkriptsiooni faktoritele, tsütoskeleti muutustele ja membraanide muutustele. On leitud, et EGF või PDGF toimel aktiveeritakse Rac-valk, see aktiveerib PLA2, vabaneb arahhidoonhape ja selle metaboliidid aktiveerivad Rho-valgu, see omakorda põhjustab aktiini kiudude tekke. Samal ajal lüsofosfatidüülhape aktiveerib Rho-valgu ilma Rac-valgu osaluseta. Mõnes Rho ja Rac valgu G-nukleotiidi vahetavas faktoris on fosfolipiididega seostumise ala. Kas ja kuidas see aktivatsioonis osaleb, pole teada. Võimalik, et Rac-valgu ülesanne ongi aktiveerida rasvhapete metaboliitide tootmist. Rac-valk on membraansete NADH oksidaaside käivitaja, s.t. aktiveerib superoksiidi radikali tootmist, see põhjustab rasvhapete oksüdeerumist membraanis. On pakutud välja skeem:
Rho inaktiveerimine ühe mürgiga, C3 transferaasiga, mis inaktiveerib ainult Rho-valku mitte Rac-valku, hoiab ära stressi fiiberite tekkimise. Inaktiivne Rac-valk, RacN17, inhibeerib nii membraani muutused kui ka stressi fiiberite tekkimise EGF või PDGF toimel.
9. Fosfatidüül-inositool-3-kinaas (PI3K) ja Akt kinaas
Ras-perekonna valkudega seotud on ka fosfatidüül-inositool-kinaasid. Rho-valgud on kompleksis lipiidide kinaasidega. PI3K on aktiveeritav mitmete signaalide poolt, tema regulaator-subühik on adaptervalk, mis seob P-Y ja ka proliini-rikast ala. PI3K katalüütiline subühik p110 katalüüsib inositooli fosforüleerimist 3-ndast positsioonist. PI3K inhibiitor on wortmannin. PI3K aktiveerib Rac1, PKC ja Ser/Thr kinaasi Akt, mida nimetatakse ka proteiinkinaas B. PI3K osaleb membraani muutuste käivitajana. Mitmest positsioonist fosforüleeritud inositooliga fosfolipiidid on signaali vahendajaid, need võivad olla osalised Rac-valgu vabastamises tema inhbiitori (GDI) küljest:
PI3K on viimastel aastatel kirjeldatud kui onkogeen, v-p3k eraldati avian sarcoma virus16 (ASV16) genoomist. Viiruseline valk on 14 am.h. lühem kui rakuline c-P3k valk, 14 am h asemel on N-otsas viiruse gag-geeni produkt, saadakse Gag-P3K liitvalk. v-P3k on 10x aktiivsem transformeerija kui c-P3k valk. PI3K toodab inositool-3-fosfaadiga lipiidseid ühendeid. Need võivad olla signaali vahendajad, mis aktiveerivad kinaasi Akt. Akt on proteiin-seriin/treoniin-kinaas, N-otsas on pleksitriin-homoloogia (PH), mis seob inositool-lipiide või fosfolipiide PI(3,4)P2, PI(3,4,5)P3. Nende abil seostub kinaas membraaniga ja aktiveerub. Mutatsioonid PH-alas blokeerivad c-Akt1 aktivatsiooni. Kinaasi viiruseline vorm v-Akt on ühe hiire retroviiruse (murine AKT8) onkovalk, Gag-Akt liitvalk, kus gag on liitunud 60ap enne c-akt initsiatsiooni koodonit, vahele on tulnud veel 3ap. Liitvalgus on seega Gag ja Akt valgu vahel veel 21 am h. Viiruseline valk on pidevalt membraaniga seotud ja aktiivne. Aktiivne Akt inhibeerib apoptoosi. Akt kinaasi märklaudadeks on ribosoomi valgu S6 kinaas ja glükogeeni süntetaasi kinaas 3 (GSK3). On leitud, et mõnedes kasvajates on üleekspresseerunud Akt2, Akt1-ga sarnane kinaas.
10. Raf valgud ja onkogenees
Raf valk on tsütoplasmaatiline seriini ja treoniini fosforüleeriv proteiin-kinaas. COOH-otsas on katalüütiline domään ja N-otsas on regulaatorala. Viimane inaktiveerib kinaasse aktiivsuse, normaalne Raf kinaas on pakitud nii, et kinaasne domään on varjestatud. Rakkude stimuleerimisel kasvufaktoriga käivitatakse signaali tee ja aktiveertakse Raf kinaas. Raf tuleb signaali ülekande kompleksi Ras valgu kaudu. Kui Raf valgust deleteerda 1. - 257. am.h., saame pidevalt aktiivse kinaasi. Sealjuures Raf valgu N-terminaalne ala 1. - 257. am.h. on inhibiitor mitte ainult Raf kinaasile, vaid kogu signaali teele: ta seostub Ras-valguga, aga kuna puudub kinaasne ala, siis edasist signaali teed ei aktiveerita. Inhibiitor ala on täpsemalt lokaliseeritud 51. - 131. am.h. kohale, see järjestus on võimeline supresseerima Ras indutseeritud kasvu. Raf valgu regulaator alas on "zinc finger" järjestus, selles on mitu tsüsteiini, signaali vastuvõtmisel ja edastamisel on olulised C165 ja C168. Selle alaga seob Raf fosfilipiide ja need võimendavad Raf aktiveerumist. Ras ja Raf sidumiseks on vajalik N-ots, kui Raf valgus fosforüleerida PKA-ga Ser43, siis Ras ja Raf ei seostu ja signaali tee supresseeritakse. Raf omab katalüütilises domäänis Ser ja Tyr fosforüleerimise kohti. Kas ja kuidas mõjub fosforüleerimine Raf aktiivsusele, pole teada, on vasturääkivaid tulemusi.
Inimesel on kolm erinevat raf geeni, c-raf on paremini uuritud, on teada kaks c-raf lookust inimese genoomis: c-raf-1, asukohaga 3p25, annab p71/73 Raf-1 valgu, c-raf-2 on pseudogeen 4. kromosoomis. A-Raf valgu jaoks on inimsel kaks geeni: A-raf-1 on X kromosoomis, Xp11, annab 67,5 kDa-lise valgu; A-raf-2 asub 7.kromosoomis alas 7p14-q21. Neist Raf valkudest suurem on B-Raf, 94 kDa, tema N-terminaalne ots on suurm kui teistel Raf valkudel. B-Raf'i jaoks on ka kaks lookust inimese genoomis: B-raf-1 asub 7q34 ja annab funktsionaalse B-Raf valgu, B-raf-2 on pseudogeen asukohaga Xq13. Raf-1 on aktiveeritav onkogeense Ras poolt, A-Raf on oluliselt aktiveeritav oncigeense Src-ga ja ka onkogeense Ras-ga. Raf-B on aktiveeritav onkogeense Ras-ga ja mitte Src-ga.
v-Raf on hiire sarkoomi viiruse 3611MSV onkovalk, homoloog inimese Raf-1-le. Erinevus seisneb selles, et viiruse valgul puudub N-ots, regulaatorala, selle asemel on viiruse gag geeni produkt. Viiruseline Raf on pidevalt aktiivne kinaas.
v-Rmil on lindude retroviiruste IC10, IC11 onkovalk, homoloog inimese B-Raf valgule.
Kasvajatest eraldatud Raf valgud sisaldavad oma N-otsas sageli Tpr järjestust, nii nagu mõned onkogeensed retseptorid. See järjestus aitab Raf valku siduda teiste valkude külge ja sellega teda aktiveerida. Raf valku saab muuta pidevalt aktiivseks ja transformeerivaks kui talle liita COOH-otsa Ras valgu modifitseeritav ala CAAX, see ala rakus farnesüleeritakse ja ots metüleerutakse. Modifitseeritud valk seotakse membraaniga. Membraaniga seotud Raf on aktiivne kinaas ja võimeline rakke transformeerima sõltumata Ras valgust. Võib-olla Ras osa Raf valgu aktiveerimises ongi tema sidumine membraanile? Kasvufaktorid aga tõstavad Raf aktiivsust veelgi, ilmselt mõjub Tyr fosforüleerimine kinaasses domäänis.
Raf kinaas aktiveerib rakus türosiini ja treoniini/seriini fosforüleerivaid kinaase MEK. Neid kinaase aktiveerib ka üks teine Ser/Thr kinaas Mos. c-Mos on 34 kDa suurune valk, reguleerib ootsüütide küpsemist, osaleb meioosis. Peale selle on leitud, et Mos aktiveerib üle MAP kinaaside kulgevat signaali teed ja võib olla rakke transformeeriv. Algselt oli Mos valk leitud sarkoomi viirustest, MoMuSV. Isolaatidest HT1 ja MSV124 on see transformeeriv geen iseloomustatud. On võrreldud c-Mos ja erinevate viiruseliste Mos valkude järjestusi. v-Mos valgud sisaldavad N-otsas 31 lisa aminohapet, millest 5 on pärit viiruse geenilt env ja ülejäänud 26 on pärit c-mos geeni esimesest otsast initsiatsiooni koodoni ja rekombinatsiooni punkti vahelt. Muus osas on c-Mos ja HT1-v-Mos identsed. MSV124-v-Mos valgus on 12 am.h. muteerunud. Kui neid valke toodeti putuka raku kultuuris, saadi valgud, milledest c-Mos ja HT1-v-Mos ei omanud kinaasset aktiivsust in vitro, 124-v-Mos oli aga pidevalt aktiivne kinaas ja fosforüleeris MEK. Selle konstitutiivse aktiivsus jaoks oli oluline 124-v-Mos valgu N-otsas toimunud mutatsioon, positsioonis 145 oli Arg asendunud Gly-ga. Kui tehti vastupidine asendus Gly 145 ® Arg 145, siis saadi inaktiivne kinaas. Arginiin 145 puhul on kinaas inaktiivne, aktivatsioon toimub stimulatsiooni järel rakus in vivo, glütsiiniga valk on aga pidevalt aktiivne ja transformeeriv. Ka see Mos-valgu näide kinnitab seda, et ühe aminohappe mutatsioon võib valku muuta nii, et see ei ole enam reguleeritav.
11. MEK ja MAP kinaasid kui onkovalgud
MEK on proteiinkinaas, mis fosforüleerib nii treoniini/seriini kui ka türosiini. Need kahese spetsiifikaga ensüümid ekspresseeruvad kõigis rakkudes ja on vajalikud rakkude kasvuks ja diferentseerumiseks. Ka MEK-valkude hulgas on konstitutiivselt aktiivseid vorme. Selliste vormide ekspressioon põhjustab NIH3T3 rakkude transformatsiooni. Dominant-negatiivsed vormid inhibeerivad seerum-indutseeritud NIH3T3 rakkude kasvu. MEK1 mutant, mis on kaotanud oma N-otsast aminohapped 32.-51.positsioonist ja seriinid 218 ja 222 on asendunud glutamiiniga, on pidevalt aktiivne kinaas. Viiruselisi onkovalke kui selle rühma kinaaside analooge pole kirjeldatud.
MAPkinaasid on aktiveeritavad treoniini ja türosiini fosforüleerimisega MEK-ide poolt. Ise fosforüleerivad nad porliini järel olevat seriini või treoniini. Siia rühma kuuluvad ERK1, ERK2, ERK5, ERK6, p38MAPK, JNK jt. Konkreetseid onkogeenseid vorme pole kirjeldatud. Kasvajates on selle rühma kinaaside aktiivsus tõusnud.
12. Signaali ülekandes osalevad transkriptsiooni faktorid kui onkovalgud
Paljude stimulaatorite poolt aktiveeritakse sellised transkriptsiooni faktorid nagu Fos ja Jun. Fos (Fos, FosB, Fra1, Fra2) ja Jun (Jun, JunB, JunD) perekonna valke vaadeldakse tuumasiseste signaali vahendajatena. Nad seostuvad homo- või heterodimeeridena DNA-le, AP1 piirkonda. Jun valk on tavaliselt rakus olemas ja tema esmane aktivatsioon toimub fosforüleerimisega. Jun valgu N-otsas on transkriptsiooni aktiveeriv domään, kui seal fosforüleeritakse PKA, PKC jt. kinaaside poolt Ser63, Ser73, siis transaktivatsiooni võime tõuseb. C-otsas on DNA-sidumise ala ja dimerisatsiooni ala, kui selle lähedalt piirkonnast fosforüleerida Ser231, Ser243, Ser249, siis DNA-ga seostumine alaneb ja valk ei ole enam aktivaator. C-ots on negatiivse regulatsiooni ala, fosforüleerimise aste seal reguleerib DNA-seostumist.
Kui võrrelda tibude rakulise ja viiruselise (lindude sarkoomi viirus ASV17) Jun-valgu ehitust, siis võib öelda, et viiruseline valk on kaotanud regulaator piirkonnad. N-otsa transaktivatsiooni alas on piirkonnad "epsilon" ja "delta", mis tagavad raku-spetsiifilise toime, "delta" ala stabiliseerib interaktsiooni inhibiitoriga. Viiruselistel Jun valkudel on see ala deleteerunud. Peale selle on muteerunud piirkond, mis reguleerib DNA-ga seostumist ja dimerisatsiooni. Kui selles alas on fosforüleeritavad seriinid asendatud, siis ei saa kinaasidega pärssida Jun-valgu ja DNA seostumist. Kui seal on Cys asendatud, siis oksüdeerijad ei saa inaktiveerida DNA-ga sidumist. Viiruselised Jun valgud on kaotanud reguleeritavuse ja on siis pidevalt DNA-ga seotud ja aktiivsed. Viiruseline Jun-valk sisaldab sageli ka retroviiruse genoomist pärit osasid: Jun-valgu N-otsa on liitunud 220 am.h. gag geenilt. Kui võrrelda selle liitvalgu geeni c-Jun geeniga, siis on näha, et viiruseline Jun mRNA on kaotanud peale 27-aminohappelist nn."delta" ala kodeeriva järjestuse ka Jun mRNA 3' UTR (mitte transleeritava ala). Selles alas on aga mRNA degradeerimist määravad signaalid, millega reguleeritakse valgu taset transkriptsiooni järgselt. Nii et viiruselise Jun-valgu taseme regulatsioon on ka rikutud. Retroviiruse kooseisus on jun geenil ka promootor muutunud: liitvalku toodetakse viiruse promootori kontrolli all.
Fos valgu süntees indutseeritakse paljude signaalide poolt. Tema geeni transkriptsiooni aktiveerivad ka Jun-homodimeerid, Fos aktivatsioonile eelnab Jun-valgu aktivatsioon, siis käivitatakse Fos-valgu süntees. Fos-valgu aktiivsuse regulatsioon toimub ka valgu tasemel, fosforüleerimisega: hiire valgus p55fos C-otsa fosforüleerimine Ser361 kohalt muudab valgu enda sünteesi supressoriks. c-Fos mRNA on väga labiilne, nii Jun kui Fos mRNA kiire degradeerimine hoiab ära nende valkude pikaajalise kõrge taseme. Analoogselt v-Jun valgule on v-Fos kaotanud negatiivse regulatsiooni piirkonnad. Näiteks, luusarkoomi viiruse onkovalk p55v-fos, FBJ-MuSV, Finkel-Biskis-Jinkins murini sarkoomi viiruses on 50 am.h. lühem kui c-Fos, deletsioon on C-otsas regulaator alas. Fos-valgu C-otsa asemele on tulnud uus järjestus, puudub fosforüleeritav Ser. Ka mRNA kiiret lagundamist tagav ala 3'UTR-is on viiruselises geenis puudu. Teine viiruseline Fos-valk, p75gag-fos, FBR-MuSV, Finkel-Biskis-Really murini sarkoomi viirusest on kaotanud N-otsast, keskelt ja C-otsast regulaator alad. Siin on liitunud fos geen viiruse gag geeniga, ekspresseerub viiruse promootori kontrolli all. Nii Jun kui Fos-valgu viiruselised vormid on kaotanud oma negatiivse regulatsiooni alad. Nende mRNA on kaotanud oma labiilsust määrava piirkonna ja nende geenide ekspressioon on kaotanud normaalse regulatsiooni.
Nii Fos kui Jun valk kuuluvad nn. BZIP (basic leucine zipper) valkude hulka. Need sisaldavad aluseliste aminohapete ala ja leutsiinist koosnevat hüdrofoobset piirkonda. See ala kokku moodusdab DNA-ga siduva domääni. Sellesse perekonda kuulub ka transkriptsiooni faktor Maf, esialgselt kirjeldatud kui lindude sarkoomi viiruse AS42 transformeeriv onkovalk. Eraldati tibude fibrosarkoomist (musculo-aponeurotic fibrosarcome). Nüüd on teada mitmeid Maf-valke: 2 põhi klassi, suured (236-270 am.h.) ja väikesed (149-162 am.h). Suured on c-Maf, MafB ja Nrl (neural retina leucine zipper), neil on transkriptsiooni aktivatsiooni domään N-otsas. Väikesed Maf-valgud on MafF, MafG ja MafK (p18), nad ei oma transaktivatsiooni ala, neis on ainult bZIP ala. MafK ja c-Maf ei ole aktiveeritavad mitogeenidega, forboolestritega ega cAMP-ga. MafG on aktiveeritav oksüdatiivse stressi poolt. Maf-valgud moodustavad dimeere nii omavahel kui ka teiste faktoritega (Jun, Fos). Viiruseline v-Maf erineb c-Maf-valgust vähe, ka c-Maf-valgu üleekspressioon võib fibroblaste transformeerida. Maf aktiveerib geene, mille promootoris on MARE (Maf recognition element). Maf faktorid moduleerivad AP1 alaga promootoreid ja reguleerivad spetiifiliste geenide ekspressiooni rakkude diferentseerumisel.
Paljude signaalide puhul aktiveeritakse ka selline transkriptsiooni faktor nagu NFk B. Esimene sellele faktorile vastav DNA järjestus leiti Ig k ahela promootoris. Seda faktorit kodeerib onkogeen c-rel. Viiruseline homoloog v-rel on lindude reticuloendotheliosi viiruse REV-T onkogeen, indutseerib lümfoidseid kasvajaid. Viirusega nakatatud rakkudes on v-Rel valk tuumas ja ka endogeenne c-Rel on põhiliselt tuumas. Mitte stimuleeritud ja mitte nakatunud rakkudes on see valk tsütoplasmas inaktiivses vormis, seotud inhibiitor-valguga. Aktivatsiooniks on vaja inhibiitor lõhkuda ja siis läheb aktiivne faktor tuuma ja seostub DNA vastava järjestusega. Inhibiitor-valk blokeerib tuuma transpordi ja ka DNA-ga sidumise. NFk B aktiveerib ka oma inhibiitori sünteesi ja see nihutab tasakaalu inaktiivse oleku poole, aktivatsioon on lühiajaline. NFk B on aktiivne dimeerina. Dimeer on kas homodimeer või heterodimeer p65 ja p50 subühikutest. p65 on kodeeritud rel geenide poolt, neli erinevat valku: Rel, RelA, RelB ja v-Rel. Väiksemad subühikud p50 ja p52 sünteesitakse suurte eellasvalkudena p104 ja p100, mis sisaldavad endas ka inhibiitor järjestust, sellisel kujul on nad inaktiivsed ja asuvad tsütoplasmas. Ka inhibiitoreid on mitu: Ik B-a , Ik B-b , Ik B-g . Inhibiitorile omast NFk B-ga sidumise kohta sisaldab ka valk Bcl-3. Erinevatest subühikutest saab tekkida mitmeid dimeere. Kõik nad seostuvad DNA järjestusele GGA(C)TTTCC, selle koha lähim ümbrus on ka oluline ja määrab sidumise affiinsuse. Iga dimeer omab erinevat affiinsust erinevatele promootoritele.
Tibude c-Rel ja v-Rel-valgu ehituse võrdlus näitab, et kõik nad kannavad N-otsas rel-homoloogia domääni (RHD) ja C-otsas transaktivatsiooni domääni. Erinevused on selles, et v-Rel on kaotanud 2 am.h. N-otsast ja 118 am.h. valgu C-otsast ja nende asemel on 11 ja 18 am.h. viiruse env geeni poolt kodeeritud, saadakse liitvalk Env-Rel-Env; peale selle 18 aminohapet on muteerunud Rel-homoloogia alas ja transkriptsiooni aktivatsiooni alas. Mõnedel andmetel v-Rel tsentraalse ala mutatsioonid vähendavad Ik Ba vahendatud inhibitsiooni. Funktsionaalselt on erinevused selles, et 1) v-Rel on konstitutiivselt tuumas, samal ajal kui c-Rel on ka üleekspressiooni tingimustes valdavalt tsütoplasmas. 2) C-otsa puudumine tõstab Rel-valgu onkogeensust 10-100 korda. Hiljuti näitasid Fujii jt.(1996) et v-Rel aktiveerib spetsiifiliselt c-jun promootori, selleks on vaja nii NFk B seostumise koht kui ka üks teine c-jun promootori ala (-52/+148). v-Rel seob c-jun promootoris olevale NFk B alale oluliselt paremini kui c-Rel. Selle määrab ära v-Rel valgu DNA-ga seostumise ala, kui see ala liita c-Rel valgu transaktivatsiooni domääniga, saadakse ka tugev aktivatsioon. Samal ajal v-Rel ei aktiveeri HIV ja SV40 promootoreid, kus on NFk B seostumise koht. c-jun aktivatsioon võib olla vajalik etapp rakkude transformatsioonis. On kaks võimalikku mehhanismi viiruselise Rel-valgu toime seletamiseks: 1) v-Rel homodimeerid käivitavad kasvufaktorite ja nende retseptorite sünteesi, toimub autokriinne stimuleerimine; 2) v-Rel homodimeerid seostuvad replikatsiooni ja raku tsükli valkudega ning aktiveerivad otse rakkude kasvu.
Kasvajatest on leitud muutunud Rel-valke: Rel-homoloogia ala on liitunud mõne teise geeniga, nrg - non-rel gene. Rel-Ngr valk sisaldab 284 am.h. inimese Rel-valgust ja 166 am.h. teisest valgust. See muutunud C-otsaga liitvalk on leitud lümfoidsetest kasvajatest. Ta seob DNA-ga, aga ilmselt ei oma transkriptsiooni aktiveerivat võimet, sest tema C-ots on puudu. Tema ülesandeks võib olla ka teatud promootorite inaktiveerimine, mida c-Rel aktiveeriks. Kas need Rel-valkudega toimunud muutused on olulised transformatsiooniks või on nad sellega kaasnev nähtus, pole teada. Väikeste subühikute eellased (p100, p105) sisaldavad inhibiitor-järjestust, kasvajatest eraldatud valkudes on see ala oluliselt väksem või asendatud mõne teise valguga. Sellised faktorid lokaliseeruvad tuumas. Väiksed subühikud transaktiveerivat domääni ei oma, nad seostuvad DNA-ga ja arvatakse olevat sageli promootori supressorid. Mõnede promootorite puhul on näidatud p52-p52 dimeeri aktiveeriv toime. Võib-olla on seal osaline mõni kolmas valk, näiteks Bcl-3. Transaktiveeriv domään on ka Bcl-3 valgus, see valk seostub tuumas p50-p50 või p52-p52 homo- või heterodimeeriga ja muudab need transkriptsiooni inhibeerijad transkriptsiooni aktiveerijateks, kas lõhkudes dimeeri ja DNA vahelise sideme või andes kompleksile transkriptsiooni võime. Bcl-3 üleekspressiooni on leitud kroonilise lümfoidse leukeemia haigetel. Haiges koes on sageli toimunud kromosoomi translokatsioon 14:19, bcl-3 kromosoomist 19 seostub Ig raske ahela lookusega (täpsemalt, a -konstantse regiooni eksoniga). Sellises rakus on Bcl-3 mRNA tase kõrgem, valku toodetakse rohkem, kodeerivas alas muutusi pole. Normaalse perifeerse vere mononukleaarsetes rakkudes on Bcl-3 geen indutseeritav, aktiveeritakse T-rakkude stimuleerimisel, haiges koes aga on tase pidevalt kõrge. Bcl-3 on onkogeen, tema üleekspressioon matkib kasvufaktori toimet, kui see toime on pidev, on see rakke transformeeriv. Kas see toimub NFk B aktiveerimise kaudu või mingil muul moel, pole teada. B-rakkude lümfoomiga on seotud 10;14 translokatsioon. Selle tagajärel p100, p52 eellasvalgu, DNA siduv domään on liitunud immunoglobuliini ca 1 lookusega. Toodetakse liitvalku Lyt 10, milles ca 1 järjestus asendab p100 C-otsa inhibiitor järjestust. Seega liitvalk on k B-spetsiiflise DNA siduva võimega. Nii et mitte-Hodgkin B-rakkude lümfoomi koes kromosoomide liitumiskohalt kodeeritakse alternatiivne NFk B subühik. Transkriptsiooni aktiveerivat võimet tal ei ole, ta võib transkriptsiooni blokeerida või koos Bcl3-ga moodustada transkriptsiooni aktiveeriva faktori. Transaktivatsiooni võimet omav ja Rel-homoloogia domääniga seostuv Bcl-3 annab koos p52 homodimeeriga aktiivse NFk B. Kuna nende subühikute tase on kõrge, surutakse teised NFk B vormid DNA-lt välja, kaob või vähemalt langeb spetsiifiline promootorite regulatsioon. Sellistes tingimustes Rel-valgu üleekspressiooni polegi vaja, aktiivse faktori moodustavad p52 dimeer ja Bcl-3.
Peale selle, et Rel-valk on ise onkogeenne, võivad mõned teised onkovalgud kasutada teda rakkude transformeerimiseks. Mõned näited, kus valgu transformatsiooni võime korreleerub NFk B aktivatsiooniga:
1) inimese T-rakkude leukeemia viirus 1 onkovalk Tax aktiveerib NFk B ja see aktivatsiooni võime korreleerub selle valgu transformatsiooni võimega. Tax valk lõhub NFk B-Ik Bb kompleksi, NFk B ei aktiveeri Ik Bb sünteesi, inhibiitori tase ei tõuse ja faktor jääb aktiivseks. Tax on ka tuuma valk, ise DNA-ga ei seostu, aga seob mitme faktoriga ja moduleerib nende toimet.
2)EBV LMP1 käivitab TNF retseptoriga assotseeruva faktori (TRAF) kaudu NFk B aktivatsiooni ja põhjustab transformatsiooni. LMP1 üleekspressioon transformeerib roti ja hiire fibroblastide kultuure.
3) Hepatiit B viiruse krooniline infektsioon põhjustab maksa kasvajaid. Oluline osa selles paistab olevat X geeni produktil pX. See on 17 kDa suurune valk, mis aktiveerib NFk B, mehhanismi pole teada, aga see ei toimu üle Ras-Raf tee.
Väga paljud viiruse valgud aktiveerivad NFk B. Kas viiruse valkudega NFk B aktivatsioon on transformatsiooniks vajalik või rakuline vastus viiruse toimele, pole täpselt teada. Selle faktori kaudu aktiveeritakse immuunvastus, see arvatakse toimuvat Ik Ba - NFk B kompleksi lõhkumise teel. NFk B aktivatsiooniks on vaja degradeerida inhibiitor valk, mis hoiab faktorit tsütoplasmas NFk B ise aktiveerib oma inhibiitori Ik Ba sünteesi ja värskelt sünteesitud inhibiitor seostub NFk B-ga ja viib selle inaktiivsesse vormi. See mehhanism hoiab ära faktori üleaktivatsiooni. Faktor on aktiveeritud lühikeseks ajaks. Kui selles mehhanismis tasakaal rikutakse, Rel-valkude üleekspressiooniga, inhibiitori tootmise supressiooniga või regulatsiooni mehhanismi puudumisega, võib see viia rakkude transformatsioonile. v-Rel ekspressioon lümfoidsetes rakkudes kaitseb neid apoptoosi eest, mitmed apoptoosi indutseerivad faktorid neile rakkudele ei mõju. Inhibiitori Ik B antisens-RNA rakkudesse viimine põhjustab transformatsiooni, mitte-degradeeritava Ik B ekspressioon rakkudes takistab transformatsiooni ja kutsub esile apoptoosi. See fakt, et NFk B inhibiitorid põhjustavad rakkude apoptoosi, annab lootust kasutada neid vähivastaste ravimitena. Muuhulgas on sellisteks inhibiitoriteks ka aspiriin ja salitsülaat.
Nii Fos, Jun kui Rel ja p52 valkude onkogeensetele vormidele on iseloomulik nende suurenenud võime DNA-ga siduda. Samal ajal on nende transkriptsiooni aktiveeriv võime mõnel juhul (Rel) hoopis kadunud. Transkriptsiooni faktori transkriptsiooni aktiveeriva võime tõus ei korreleeru tema onkogeensusega, küll aga paistab sellega seotud olema tema hulk ja DNA-ga sidumine.
Kokkuvõtteks võib öelda, et transformeerunud rakkudes on signaali ülekandes osalevad valgud sageli muutunud, regulatsiooni mehhanismid on rikutud. Valdavalt on mutatsioonid sellised, mis tagavad PTK-Ras-Raf-MAPK signaali tee aktiveeritud oleku tõusu, negatiivse regulatsiooni alad on signaali raja valkudes kadunud. Kas see on transformatsiooni protsessi põhjustaja, tagajärg või kaasnev nähtus, pole teada. Ühelt poolt võib järeldada, et mutatsioonide tõttu pidevalt aktiivse signaali teega rakul on suurem tõenäosus muutuda kontrollimatult kasvajaks. Teiselt poolt, võib-olla on vastavad mutatsioonid tekkinud sellepärast, et signaali tee on pikka aega olnud ülekoormatud.
A.Aaronson, Growth factors and cancer, Science 1991, 254, 1146-1153.
H.R. Bourne et al., The GTPase superfamily, Nature 1991, 349,117-127.
K.Forsberg et al. , PDGF in oncogenesis, PNAS 1993, 90, 393-397
C.S. Zong et al., Molecular and biochemical bases for activation of the transforming potential of the proto-oncogene c-ros, J. Virology, 1993, 67, 6453-6462.
M.S. Boguski and F. McCormick, Proteins regulating Ras and its relatives, Nature1993, 366, 643-653.
W.C. Dougall et al., The neu-oncogene, Oncogene 1994, 9, 2109-2123.
J. Avruch et al., Raf meets Ras, TIBS 1994, 19, 279-283.
P.A. Baeuerle and T. Henkel, Function and activation of NFk B in the immune system, Annu. Rev. Immunol. 1994, 12, 141-179.
T. Erpel and S.A. Courtneidge, Src family protein tyrosine kinases and cellular signal transduction pathways, Cur.Op.Cell Biology 1995, 7, 176-182.
G. Superti-Furga and S.A. Courtneidge, Structure-function relationship in src family and related protein tyrosine kinases, BioEssays 1995,17, 321-330.
P.Chardin et al., The Grb2 adaptor, FEBS Letters 1995,369, 47-51.
A. Roulston et al., Regulation of HIV1 and cytokine gene expression in myeloid cells by NFk B/Rel transcription factors., Microbiol. Review 1995, 59, 481-505
S.-W. Chung and P.M.C. Wong, The biology of Abl during hemopoietic stem cell differentiation and development., Oncogene 1995, 10, 1261-1268.
S.J. Baker and E.P. Reddy, Transducers of life and death, Oncogene 1996, 12,1-9
H. Hsu et al., TRADD-TRAF2 and TRADD-FADD interactions define two distinct TNFR 1 signal transduction pathways, Cell 1996, 84, 299-308.
T.D. Gilmore et al., Rel/NFk B/Ik B proteins and cancer., Oncogene 1996, 13,1367-1378.
K. Senechal and C.L. Sawyers, Signal transduction-based strategies for the treatment of chronic myelogenous leukemia., Molec. Medicine Today, Dec.1996
A.S. Messerschmitt et al., DNA tumor viruses and Src family tyrosine kinases, an intimate relationship., Virology 1997, 227, 271-180.
T.Huter, Oncoprotein networks., Cell 1997, 88, 333-346.
A.S. Messerschmitt et al., DNA tumor viruses and Src famoly tyrosine kinases, an intimate relationship., Virology 1997, 227, 271/280.
V.Blank and N.C.Andrews, The Maf transkription factors: regulators of differentiation., TIBS,1997, November,437-441.
J.Massegue et al., TGF-b signalling through the Smad pathway., trends in cell biology,1997,7,187-191.
L.Van Aelst and C.D’Souza-Schorey, Rho GTPases and signaling networks.,
Genes & Development 1997, 11,2295-2322.
ONCOGENE 1998, 17 , Review Issue