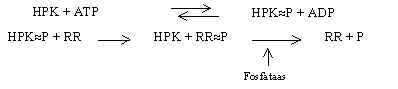SIGNAALI TRANSDUKTSIOON PROKARIOOTSES RAKUS
1. Regulatsiooni mehhanismidest bakteri rakus
Bakteri rakk on väga ökonoomne rakk. Ühelt poolt on ta väga hästi kohanenud oma kasvu tingimustele. Teiselt poolt omab ta piisavalt head reageerimise võimet keskkonna tingimustele.
Bakter võib kogu oma elutegevuse üles ehitada ühele energia allikale toetudes. Konkreetses keskkonnas on bakter kohanenud ühele seal enam levinud ja bakterile energeetiliselt kõige sobivamale substraadile. Selle substraadi metabolismi ensüümid toodetakse konstitutiivselt. Kui tal on võimalik kasutada seda kõige sobivamat substraati, siis ta teisi ei kasuta. See on nn. kataboolne repressioon. Klassikaline näide, kus glükoos represseerib teiste substraatide kasutamise. Niikaua kui on võimalik konstitutiivselt sünteesitavate ensüümidega ära elada pole kasulik tootma hakata teiste substraatide kasutamise ensüüme. See variant on rakule energeetiliselt kõige sobivam. Kõigil bakteritel ei ole glükoos eelistatuim substraat: Clostridium tetanomorphum eelistab L-glutamaati, Alcaligenes eutrophus eelistab energia allikana vesinikku. Kataboolne repressioon on siis, kui rakk eelistab kasutada endale kõige sobivamat energia allikat ja jätab teised kasutamata. Kui keskkonda ilmub ühend, mis on bakteri rakus kasutatav kui valmis produkt, siis selle süntees rakus lõpetatakse ja see võetakse keskkonnast valmis kujul. See regulatsiooni mehhanism on lõpp-produktiga repressioon, s.t. mingi ühendi sünteesiks vaja minevate ensüümide süntees katkestatakse, kui see ühend tuuakse rakku väljast poolt, või on teda rakus endas juba liiga palju toodetud.
Kui bakter ei saa oma eelistatud substraati kasutada, siis peab ta hakkama sünteesima teise substraadi kasutamiseks ensüüme: indutseeritakse sisse tuleva uue substraadi lagundamise ensüümid, sageli selle substraadi poolt. See on substraadiga induktsioon kui substraat indutseerib rakus enda lagundamise ensüüme.
On ühendeid, mida bakter ei saa ignoreerida ja mitte kasutada kui nad keskkonnas on. Need on ühendid, mis tulevad läbi raku seina ja membraanide rakku, neid peab bakter hakkama lagundama ka siis, kui ta ei vaja neid energia allikana. Mullabakterid Pseudomonas sünteesivad aromaatsete ühendite lagundamise ensüüme. Neil bakteritel on aromaatse tuuma lagundamiseks mitu võimalikku rada, mille ensüümid indutseeritakse substraadiga. Kataboolsete radade analüüsil võib täheldada, et iga aromaatne ühend indutseerib sellise lagunemise raja, mida mööda on ta keemiliselt kõige kergemini lagundatav. Teatavasti võib aromaatse tuumaga seotud rühmade (-OH, -CH3, -COOH, -Cl jt.) iseloomu ja paigutuse järgi öelda, milline side on aromaatses tuumas kõige sobivam elektrofiilsele atakile, kas orto- või meta-side. Oksügenaasne lagundamine algab hapniku elektrofiilse atakiga aromaatsesse tuuma. Aromaatsete ühendite lagundamist tuuakse näiteks ka sellisele induktsiooni mehanismile nagu produktiga induktsioon, s.t. algul lagundatakse substraati madalal konstitutiivsel tasemel sünteesitud ensüümiga ja kui seda jääb väheks, subatraati on palju ja reaktsiooni produkt hakkab kogunema, siis see produkt võib olla induktoriks teda ennast tootvate ensüümide taseme tõusule. Klassikaline näide: katehooli lagundamine katehool-1,2-dioksügenaasiga indutseeritakse tema lagunemise produkti cis-cis-mukonaadi poolt. Katehool-1,2-dioksügenaasile on cis-cis-mukonaat produkt-induktor, aga järgnevatele ensüümidele, mis mukonaati lagundavad, on ta substraat-induktor. Kui bakteril on võimalik kasutada ühe ühendi lagundamiseks nii substraadiga indutseeritud teed kui produktiga indutseeritud rada, siis on eelistatud substraadiga induktsioon. Näiteks, P.putida, mis omab TOL plasmiidi, lagundab bensoaati meta-rada pidi, sest see on substraadiga indutseeritav. Kuigi energeetiliselt oleks kasulikum bensoaadist tekkinud katehooli lõhkuda orto-rada mööda. Bensoaadil kasvatamisel need bakterid sageli kaotavad TOL plasmiidsed geenid ja hakkavad kasutama kromosomaalset, produktiga indutseeritavat orto-rada. Seda rada kasutavad bakterid kasvavad kiiremini ja selekteeruvad sellest populatsioonist. Kui ei ole keskkonnas selekteerivat substraati, mis sunniks kasutama mingit ainuvõimalikku metabolismi rada, siis kinnistuvad need mutatsioonid, mis lubavad bakteril kasutada energeetiliselt sobivaimat teed. Bakterid oskavad oma energeetilisi võimalusi väga täpselt hinnata ja kasutada.
Põhiline regulatsioon on geeni ekspressiooni induktsiooni ja repressiooni tasemel.
Kuidas neid repressiooni ja induktsiooni protsesse reguleeritakse? Kas osalevad ainult otseselt induktor ja repressor-valk, mis on igal konkreetsel juhul spetsiifiline, või on mingeid üldiseid signaali vahendajaid, mis esinevad paljudes bakterites ja paljudes protsessides? Üks selline paljude geenide reguleerija on cAMP. Valkudest osalevad signaali ülekandes sageli histidiin-proteiinkinaasid.
2. Tsükliline AMP (cAMP).
Analoogselt eukariootidega on ka bakteris üks olulisi signaali vahendajaid cAMP. Praeguseks on teada juba suur hulk funktsioone, mida rakus reguleeritakse cAMP-ga. Tabelis 1 on neist osa toodud, cAMP osa uurimiseks ja tõestamiseks on kasutatud mitmeid meetoteid: tundlikkust kataboolsele repressioonile, eksogeense cAMP mõju, cAMP mõõtmine, geneetilised andmed cya ja crp mutantsetest tüvedest, biokeemilised katsed in vitro, sekveneerimine näitab CRP sidumise kohta ja kasutades reportergeeni liitmist uuritavale promootorile mõõdetakse selle ekspressiooni. Esimene cAMP osalusel kulgev reguleerimine leiti lac-operoni juures: kui rakud lõpetasid glükoosi kasutamise ja läksid üle laktoosi kasutamisele, siis selle üleminekuga kaasnes cAMP taseme tõus rakus. cAMP on vajalik lac-operoni transkribeerimiseks. Tabelist on näha, et cAMP osaleb ka adenülaat-tsüklaasi ja cAMP-retseptor-valgu tootmise regulatsioonis.
cAMP saadakse adenülaat-tsüklaasi toimel ATP-st. Adenülaat-tsüklaas (AC) sünteesitakse cya geenilt. Selle geeni ekspressiooni kontrollib cAMP kompleksis oma retseptor-valguga (CRP): kui cAMP on palju, siis AC süntees blokeeritakse ja cAMP tootmine lõpeb. Nii et cAMP kontrollib enda tootmist, reguleerib seda negatiivselt.
Tabel 1. cAMP on E .coli ja S. typhimurium rakkudes mitmete funktsioonide reguleerija.
Geen Funktsioon ani pH-reguleeritud geenide ekspressioon ansB L-asparaginaas II ekspressioon appR happelise fosfataasi ekspressioon cat kloramfenikool atsetüültransferaasi ekspressioon ccd desoksütsütidiini deaminaasi ekspressioon cea colitsiin E1 induktsioon cidA N-atsetüülglükoosamiini katabolism cir colitsiin I retseptori ekspressioon cpdB 2’,3’-tsüklilise fosfodiesteraasi ekspressioon crp cAMP retseptor-valgu ekspressioon cup süsivesikute rakku tulek cya adenülaat-tsüklaasi ekspressioon dnaA cAMP allosteeriline effektori ekspressioon exuT galaktosiidide metabolism fadBC rasvhapete kasutamine flaABD viburite süntees fru fruktoosi reguloni ekspressioon glgC glükogeeni süntees ilvA treoniini deaminaasi ekspressioon ilvB atsetohüdroksühappe süntaas I ekspressioon sdh suktsinaadi dehüdrogenaasi operoni reguleerimine SpeC ornitiini dekarboksülaasi ekspressioon Tdc treoniini dehüdrataasi ekspressioon ToxAB enterotoksiini tootmine Tsx välismembraani valgu tootmine, galaktosiidi metabolism uxaCA vastus temperatuuri tõusule, pH-tundlik kasv, tiosulfaadi reduktsioon, jt.
AC aktiivsust reguleeritakse kolmel tasemel: 1) transkriptsiooniliselt - cya-geeni kontroll-regioonis on 3 promootorit, tugavaim neist omab CRP-cAMP kompleksi sidumise kohta, sinna seostunud CRP-cAMP kompleks alandab ekspressiooni 4-5x; 2) translatsiooni tasemel - cya-geenis on initsiatsiooni koodoniks UUG AUG asemel, UUG-lt initseeritakse translatsiooni halvasti, AC süntees on takistatud; 3) translatsiooni järgselt - AC fosforüleerimine tõstab tema aktiivsust, on olemas ka vastav proteiinkinaas ja ilmselt ka fosfataas. Glükoosi juuresolekul AC defosforüleeritakse ja alandatakse sellega tema aktiivsust. Glükoosi olemasolul fosforüleeritakse glükoos ja algatatakse tema lagundamine. cAMP tase rakus ei või olla väga kõrge: cya-geeni ekspressiooni tõus üle 6x on rakule surmav.
AC on oluline ensüüm ka bakteri ja tema peremees-raku vahelisel kontaktil: koolera toksiin ribosüleerib G-valgu a -subühiku, see kaotab GTP-aasse aktiivsuse ja on pidevalt AC aktiveerivas olekus. Selle tagajärel tõuseb eukariootse AC aktiivsus ja cAMP tase. Bordetella pertussis ja Bacillus anthracis toodavad AC, mis tungib peremees-rakku ja tõstab seal cAMP taset, see AC on Ca/kalmoduliin sõltuv (Ca/kalmoduliiniga seotult tõuseb B.pertussise AC aktiivsus 1000x). Bakteris endas kalmoduliini ei ole ja seal see AC aktiivne ei olegi, kuid peremees-rakku viidult muutub aktiivseks. Sageli toodavad bakterid ka valku, mis aitab AC tungida peremees-rakku. Seal küll sisseviidud AC lõhutakse ATP-sõltuva proteinaasi poolt, aga ajutiselt võib AC tase liiga kõrgeks tõusta. Rhizobium meliloti sisaldab cya-geeni, mille järjestus on väga erinev E.coli ja B.pertussise vastavast geenist ja sarnaneb eukariootse AC-ga.
AC aktiivsust bakteri rakus kontrollitakse mehhanismiga, mis tunnetab kasvu tingimusi, selles osalevad membraansed transport-valgud, vähemalt suhkrute transport reguleerib AC aktiivsust.
AC omab bakteris kahte funktsiooni: 1) oma geenide regulatsiooniks vajaliku cAMP tootmine ja 2) sisse tungimine nakatatavasse peremees-rakku, seal takistab peremees-rakul bakteri sissetungile vastu hakata, halvab peremees-raku signaali teid.
3. cAMP retseptor.
E.coli's cAMP ei aktiveeri kinaase, vaid aktiveerib cAMP retseptor-valgu (CRP), see on DNA-ga seostuv valk, mis moduleerib mitmete geenide ekspressiooni. cAMP seostub retseptor-valguga. Seda valku E.coli's kodeerib crp-geen. Järjestuselt on identsed E.coli, ja Shigella flexneri geenid.
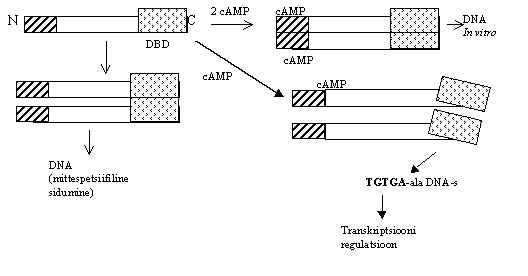
Pildil 1 on skeem CRP toimest. CRP on 47 kD valk, 2 identset subühikut moodustavad aktiivse vormi, kumbgi subühik seob 1 cAMP molekuli. Iga subühik on volditud kahte domääni: N-terminaalne domään sisaldab b -lehe struktuuri ja moodustab cAMP sidumise tasku. C-terminaalne ala moodustab a -heliksi, mis annab DNA-siduva pinna. cAMP sidumine CRP-le modifitseerib CRP struktuuri ja indutseerib järjestus-spetsiifilise DNA äratundmise. cAMP puudumisel on CRP resistentne proteaasidele ja seostub DNA-ga mittespetsiifiliselt. cAMP juuresolekul valk kiiresti degradeeritakse proteaaside poolt, DNA-ga seostub aga järjestus-spetsiifiliselt.
Pilt 1. cAMP retseptor-valk ja tema aktivatsioon.
On 3 CRP konformatsiooni: I - vaba CRP dimeer; II - CRP-CRP-cAMP, CRP(cAMP)1, 1 CRP monomeer on sidunud cAMP; III - CRP(cAMP)2 , CRP dimeer, mille mõlemad osad on sidunud cAMP. Rakus on 3000-6000 CRP molekuli ja mõni tuhat cAMP molekuli. CRP(cAMP) eksisteerib cAMP kontsentratsioonidel 0-200m M; CRP(cAMP)2 on 200m M - 15mM cAMP kontsentratsioonidel; füsioloogiline cAMP kontsentratsioon on 0-110m M. Nii et rakus on siis normaalselt CRP(cAMP) kompleks. CRP-cAMP kompleks funktsioneerib kui transkriptsiooni kontroll. CRP(cAMP)2 in vitro seob DNA-ga, kuidas see rakus mõjub, pole teada. CRP(cAMP) võib olla nii positiivne kui ka negatiivne regulaator.
CRP(cAMP) kompleksi moodustamine ja DNA-ga sidumine sõltub:
- cAMP kontsentratsioonist,
- CRP tasemest,
- DNA järjestusest,
- teistest DNA-ga seostuvatest valkudest,
CRP(cAMP)-DNA kompleksi aktiivsus sõltub:
- CRP ja RNA polümeraasi sidumiskohtade omavahelisest kaugusest,
- valk-valk kontaktidest,
- DNA käändumisest (bending),
- DNA superspiraalsusest.
CRP(cAMP) seostub lac-promootoris järjestusele AAATGTGATCT.AGATCACATTT, sellise järjestuse vastu omab CRP(cAMP) 450x suuremat affiinsust kui muteeritud lac-promootori vastu (7 positsiooni on muudetud). On leitud, et CRP(cAMP) peab siduma RNA polümeraasiga samale DNA spiraali poolele, aktivatsiooni võime väheneb kaugenedes transkriptsiooni alguspunktist. CRP käänab DNA 90° -130° . CRP(cAMP) seostub koos RNA polümeraasiga ühise kompleksina promootorile, kuid mõnele promootorile võib ka üksi siduda (lacP2).
CRP(cAMP) reguleerib mitmesuguste mehhanismide abil geene:
1) represseerib cya geeni, seob -20...+11 alal ja ei lase polümeraasi siduda.
2) gal-operonis, kus on 2 promootorit, CRP seob regulaator-alale ja represseerib gal P2 ja aktiveerib gal P1, suunab RNA polümeraasi gal P1-le, transkriptsioon tõuseb.
3) crp geeni represseerib sellega, et aktiveerib antisens RNA sünteesi, mis spetsiifiliselt blokeerib crp transkriptsiooni.
4) CRP(cAMP) on korepressor: seostub deo P2-le -20...-53 ja -80....-106 positsioonides ja sellega aktiveerib transkriptsiooni 30x, kuid CRP(cAMP)-le võib siduda repressor CytR ja sellisel juhul transkriptsioon langeb. Ka nupG promootoril käituvad need valgud CytR ja CRP-cAMP analoogselt, see süsteem reguleerib nukleotiidide transporti läbi membraani. Nii et CRP võib olla ühele piirkonnale nii aktivaator kui ka korepressor.
CRP reguleerib veel paljusid geene. Nälgimisel indutseeritakse 30 uue valgu süntees, neist 20 on cAMP sõltuvad.
4. Proteiinkinaasid.
Proteiinkinaasid osalevad ka bakteris signaali kandmises. Kui eukariootides toimub signaali edastamine põhiliselt hüdroksüülrühma fosforüleerimisega seriini, treoniini ja türosiini jäägis, siis bakteris on signaali ülekande valkudeks histidiin-proteiin-kinaasid (HPK) ja neile vastavad vastuse regulaatorid (RR). Neid on iseloomustatud mitmetel liikidel.
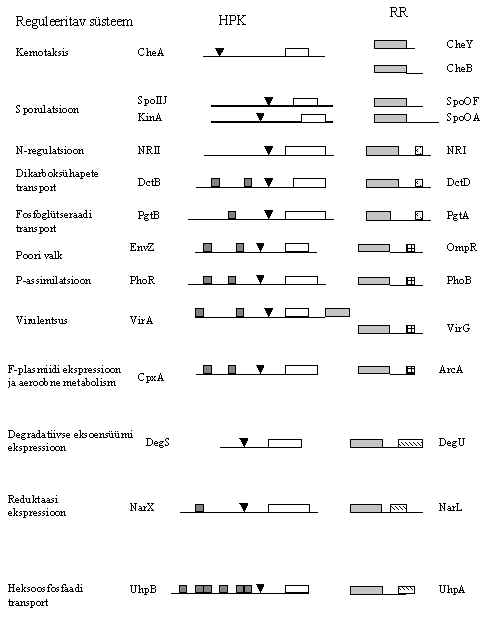
Pildil 2 on proteiin-histidiin-kinaasid ja neile vastavad regulaator-valgud. HPK omavad 100 aminohappelist homoloogset ala COOH-otsas (hele ristkülik), teine homoloogne ala on konserveerunud histidiini ümbruses (tume kolmnurk), paljudel on ka transmembraansed alad (tume ruut), sarnaselt retseptoritele. Kinaasne domään fosforüleerib samas valgus histidiini. Mõnede kinaaside puhul on näidatud, et kinaas on aktiivne dimeerina, kus üks subühik seob ATP ja fosforüleerib teise subühiku histidiini. Sama ensüüm kannab histidiinilt fosfaadi üle teise valgu aspartaadile. See teine valk on vatuse regulaator. Igale kinaasile vastab oma vastuse regulaator (RR). Vastuse regulaatorid omavad homoloogset N-terminaalset ala (100 am.h.) (hall ristkülik). On veel teisigi homoloogseid piirkondi, nende järgi võib valke alarühmadesse jagada. Mõnel kinaasil on nii histidiini kinaasne ala kui ka fosforüleeritav aspartaat ühes ja samas valgus, kinaas ja vastuse regulaator on sel juhul üks valk (näiteks VirA). Mõnele histidiinkinaasile vastab mitu vastuse regulaatorit, nad võivad kanda fosfaadi üle mitmele erinevale valgule (näiteks CheA).
Pilt 2. Bakteriaalsed signaali ülekande valgud: histidiin-proteiinkinaasid ja vastuse regulaatorid.
Histidiini ja aspartaadi fosforüleerimist kirjeldab järgmine reaktsioon:
Fosforüleeritud histidiiniga valk funktsioneerib fosfaadi doonorina ja võimaldab fosforüleerida substraadis aspartaadi jääki. Fosfohistidiinil on kõrge negatiivne vaba energia, mida suurem on negatiivne hüdrolüüsi vaba energia, seda kergemini annab ühend ära oma hüdrolüüsitava rühma. Fosfohistidiin on hea fosfaadi doonor. Aspartaadi fosforüleerimisel on valgu sees oleva aspartaadi fosforüleerimine positiivse vaba energiaga (+2) ja vabas olekus oleval aspartaadil negatiivne (-10). Sellisel juhul fosfaatrühma seostumine valguga peaks põhjustama konformatsiooni muutuse. See konformatsiooni muutus ongi signaali edastamisel oluline, ta aktiveerib regulaator-valgu mingi funktsiooni.
Bakteris osalevad signaali edastamises histidiini ja aspartaadi fosforüleerimine ning defosforüleerimine.
Mõnedel kinaasidel on 2 transmembraanset ala, nende vahele jääv ala on periplasmas ja võtab signaali vastu. Nad on membraansed retseptorid. Signaal võib lähtuda ka raku seest, siis on tsütoplasmaatiline retseptor. Esimeses ringis retseptor aktiveeritakse ja inaktiveeritakse, teises ringis, mis puutub kokku aktiveeritud retseptoriga, aktiveeritakse ja inaktiveeritakse vastuvõtja. Aktiveeritud vastuvõtja annab signaali edasi, fosforüleeritud respons-regulaator kontrollib näiteks paljude geenide ekspressiooni. Aktiveeritud regulaator võib olla mitmesuguste protsesside käivitaja, reguleerides näiteks bakteri liikumist.
Järgmistel piltidel on näited sellest, kuidas konkreetsed kinaasid töötavad. Kahel juhul on tegemist membraanste retseptoritega. Neist üks membraanne retseptor on HPK, mis aktiveeritakse välistingimuste muutusega, teisel juhul retseptorid annavad signaali edasi läbi teiste valkude HPK-le. Ühel skeemil on HPK aktiveerija tsütoplasmaatiline valk, mida mõjutavad rakusisesed muutused. Mõned HPK-d käituvad nii kinaasidena kui ka fosfataasidena oma vastuse regulaatori suhtes.
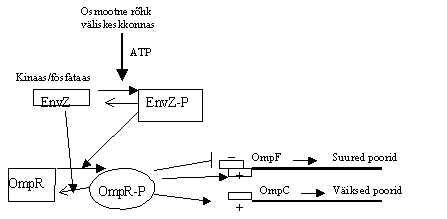
Pilt 3. Bakteri vastus osmootse rõhu muutustele.
Pildil 3 on skeem bakteri seina pooride regulatsioonist. Osmootse rõhu muutumisele keskkonnas reageerib rakk pooride suuruse muutmisega raku välisseinas. E.coli K12 tüvel on 2 põhilist poriini, poore moodustavat valku. OmpF moodustab suuri poore ja OmpC moodustab väikseid poore. Nende kahe valgu suhe muutub osmootilise olukorra muutumisel: madalas osmootses jõus on suured poorid, rohkem OmpF valku, ja kõrges osmootses rõhus on väiksed poorid, rohkem OmpC valku. Regulatsioon käib histidiin proteiin kinaasi EnvZ abil: rõhu suurenedes suureneb EnvZ fosforüleerud vormi hulk EnvZ-P, see fosforüleerib vastava respons-regulaatori OmpR ® OmpR-P. OmpR-P kontrollib transkriptsiooni omp-geenidelt. Kui OmpR-P on palju, siis ta indutseerib väikesed poorid ja inhibeerib suured poorid, sest suure poori valgu geenile on kõrge OmpR-P tase repressor: promootoris on kõrge affiinsusega aktiveerimise koht (+) ja madala affiinsusega represseerimise koht (-). OmpC geeni promootoris on ainult aktiveeriv sidumiskoht. Kui OmpR-P on vähe, sünteesitakse suure poori valk. EnvZ on tüüpiline membraanne retseptor-valk: tsütoplasmaatiline ala on kinaas, mis fosforüleerib ennast histidiini jäägist ja kannab fosfaadi üle OmpR-le, ta võib OmpR-P ka defosforüleerida, käituda fosfataasina. On leitud veel üks paar, mis reguleerib E.coli elu osmoosi muutumisel: KdpD on proteiin kinaas ja KdpE on vastav regulaator.
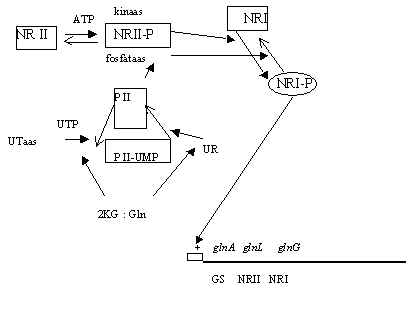
Pilt 4. Lämmastiku metabolismi regulatsioon.
Teine skeem on lämmastiku metabolismi regulatsioonist. Glutamiini süntetaasi (GS) geen (glnA) lülitatakse sisse, kui glutamiini tase langeb. Transkriptsiooni aktivaator on valk NRI-P, mis fosforüleeritud kujul aktiveerib glnA geeni. NRI fosforüleerimist kontrollib histidiin-kinaas NRII , selle aktivatsiooni kontrollib süsiniku ja lämmastiku metabolismi suhe, a -ketoglutaraadi (2KG) ja glutamiini (Gln) suhe. See suhe mõjutab bifunktsionaalset ensüümi UTaas/UR (glnD geeni produkt), mis uridüleerib ja deuridüleerib türosiini jääke regulator-valgus PII. Viimane on trimeerne valk, glnB geeni produkt, 12,4 kDa, uridüleeritakse Tyr51 ja see muudab valgu konformatsiooni. Kui N on limiteeriv, 2-ketoglutaraat indutseerib PII konformatsiooni muutuse, mis lubab teda uridüleerida. Kui glutamiini on piisavalt, siis ta seostub UTaasiga ja inhibeerib uridüleerimise. Valk PII on keskkonna tundlik faktor, mis kontrollib histidiini kinaasi fosforüleerimist. NRII (e. NtrB) on dimeerne valk, milles üks ahel fosforüleerib teise ahela His 139. Fosforüleeritud histidiin kinaas NRII-P kannab fosfaadi üle transkriptsiooni faktorile NRI-le. NRI (e.NtrC) on ka dimeerne valk, subühik 55 kD, fosforüleeritakse Asp 54. See fosforüleerimine stimuleerib subühikute oligomeriseerumise ja seostumise DNA-ga. NRI-P käivitab transkriptsiooni. Ka siin käitub NRII fosfataasina ja võib NRI-P defosforüleerida. His 139 on oluline kinaasse funktsiooni jaoks, aga mitte fosfataasse aktiivsuse jaoks. Kui PII ei ole uridüleeritud, siis aktiveerib ta NRII fosfataasset toimet, alandab NRI-P fosforüleerimist, ja siis alaneb glnA geeni transkriptsioon. glnA geen on samas operonis NRII ja NRI geeniga. Kui N on limiteeriv, siis PII on uridüleeritud, siis fosforüleeritud regulaatori hulk suureneb ja aktiveerib transkriptsiooni, suureneb glutamiini süntetaasi hulk ja ka regulaatori ning kinaasi hulk. Siin on histidiin proteiin kinaas tsütoplasmaatiline retseptor, mida moduleeritakse raku siseseid muutusi tunnetava valgu poolt. On leitud analoogseid valke, mis reageerivad väliskeskonnas olevale lämmastikule.
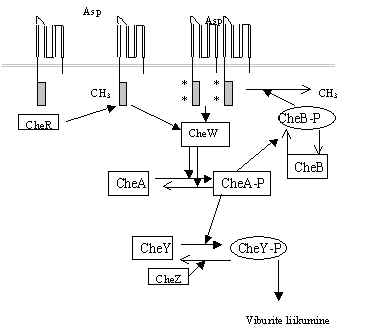
Pilt 5. Histidiinkinaasid ja kemotaksis.
Toitained või teised ühendid keskkonnas
Kolmas skeem histidiin kinaaside osalemisest signaali kandmises on selline, kus signaal ei lähe tuuma, vaid käivitab bakteri mootori ja bakter ujub toitaine rikkamasse keskkonna ossa või eemale mürgisest ühendist. Signaal algab membraansest retseptorist. Retseptor, antud pildil aspartaati siduv retseptor, koosneb kahest 60kD subühikust. Iga alaühik omab 2 membraani läbivat ala. Aktiivne, aspartaati siduv domään tekib kahe alaühiku ühinemisel retseptori rakuvälises alas. Aspartaadi seostumisel membraansed retseptorid muudavad oma tsütoplasmaatilist osa. See muutus aktiveerib valgu CheW, mis omakorda mõjutab histidiin-kinaasi CheA aktiivsust. Ligandiga retseptor alandab CheA autofosforüleeritust. Tühi aminohappe retseptor suurendab histidiini fosforüleeritust, ja CheA kannab fosfaadi üle respons-regulaatorile CheY. Fosforüleeritud aspartaadiga CheY seostub mootoriga ja kontrollib selle liikumist. Siin on eraldi fosfataas CheZ, mis defosforüleerib CheY-P. Membraansete retseptorite tundlikkust reguleeritakse ka osaliselt sama süsteemiga. Retseptorid metüleeritakse S-adenosüül-metioniin sõltuva proteiin-glutamaat-O-metüül transferaasiga CheR ja see tõstab nende tundlikkust. Metüleeritud retseptorid (*) seovad aminohappe ka madalatel aminohappe kontsentratsioonidel. Demetüleerimiseks on glutamaat-metüül esteraas CheB, mis kuulub respons-regulaatorite hulka, teda fosforüleerib histidiin-kinaas CheA. CheB-P eluiga on mõni sekund, ta defosforüleeritakse kiiresti, ja jälle võib retseptorite tundlikkus tõusta.
In vitro tingimustes võib CheA fosforüleerida ka NRI ja OmpR, EnvZ on võimeline fosforüleerima NRI ja CheY. Kui EnvZ periplasmaatiline ala asendada aspartaadi retseptori rakuvälise alaga, siis hakkab aspartaat reguleerima pooride suurust.
Histidiin-kinaaside COOH-otsa konserveerunud järjestus on vajalik ATP sidumiseks ja histidiini fosforüleerimiseks. Fosfotransferaasne aktiivsus on N-terminaalses osas. Bakteri histidiin-kinaasid on analoogsed eukariootse raku türosiin-proteiin-kinaasidega. Siinsed signaali ülekande valgud on sageli olenevalt tingimustest kas fosfataasse või kinaasse aktiivsusega.
Tabelis on üks B. subtilis sporulatsiooni initseeriv transkriptsiooni faktor Spo0A. Seda aktiveerib histidiin-proteiin-kinaas KinA, aga mitte otse vaid üle Spo0F. Viimast fosforüleerivad ka mitmed teised kinaasid ja temalt kannab fosfaadi üle Spo0A-le fosfoproteiin-fosfotransferaas Spo0B. Kinaasi KinA inhibeerivad cis-küllastumata rasvhapped. Need inhibeerivad KinA autofosforüleerimise. Membraansed rasvhapped kontrollivad sporulatsiooni. Kui küllastumata rasvhppeid ei ole, käivitatakse sporulatsioon. Spooride membraanid sisaldavad rohkem küllastunud rasvhappeid ja vähem küllastamata rasvhappeid.
Üldiselt nimetatakse sellist histidiin-proteiinkinaasist ja fosforüleeritava aspartaadiga regulaatorist koosnevat kompleksi bakteri kahekomponentseks signaal-süsteemiks. Paljudes bakteri ja väliskeskkonna vahelistes suhetes osaleb selline 2-komponentne signaal-süsteem. Paljud bakterivalgud on fosforüleeritud ka seriini ja türosiini jäägist, bakteris on olemas ka seriin- ja türosiinkinaasid ja vastavad fosfataasid.
Peale proteiin-kinaaside on bakteris leitud ka GTP siduvaid membraan-seoselisi valke, mis võiksid osaleda signaali edastamises. Sporulatsiooni regulatsioonis osaleb G-valk, obg geeni produkt, teda transkribeeritakse koos SpoOB valguga. Obg-valk on samuti nõrk GTP-aas nagu eukariootne Ras-valk.
Lõpuks veel üks bakterite ja signaliseerimisega ja eukariootsete rakkudega seotud probleem. Patogeensed bakterid nakatavad eukariootset rakku. Bakteritel on geenid, mis kodeerivad bakteri rakku tungimiseks vajalikke valke. Yersinia omab selleks geene inv ja ail ; Shigella flexneri omab 3 pinna valku kodeerivat geeni ipaB, ipaC, ipaD; Salmonella typhimurium kannab 5 geeni, mis tagavad tema rakku tungimise. Ivasiooni geenid ekspresseeruvad siis, kui neid on vaja, näit. 37° juures. Yersinia valk invasiin seostub raku pinnal integriinidega, tekivad integriinide kogumid bakteri ja epiteeli raku kontakt pinnal. Integriini kogumid aktiveerivad rakus türosiinkinaase, käivitatakse signaali tee, mis tagab bakteri rakku võtmise. PTK inhibiitorid võivad blokeerida bakteri rakku mineku. Bakterid toodavad valke, mis sekkuvad peremees-raku signaali ahelasse. E.coli toodab valku, mis aktiveerib eukariootseid PTK ja PKC. Mitmete bakterite rakku minekul aktiveeritakse PLC ja PKC. Salmonella ja Yersinia jäävad rakus membraaniga ümbritsetud vakuooli ja eritavad tsütoplasmasse türosiin-proteiin-fosfataase, mis takistavad rakus normaalset signaali ülekannet.
Bakteris on süsteemid kaitsmaks teda ka oksüdatiivse stressi eest. E.coli omab OxyR ja SoxR/S faktoreid. OxyR transkriptsiooni faktor on aktiveeritav vesinikperoksiidi poolt ja indutseerib katalaasi tootmise. SoxR on superoksiidi poolt aktiveeritav, valk sisaldab Fe-S kompleksi ja see on oksüdeerijale tundlik. Selle faktori kaudu käivitatakse ka MnSOD tootmine. Antioksüdantsed ensüümid kaitsevad bakterit ka peremees-rakuga kohtumisel: bakterit ründavad makrofaagid toodavad superoksiidi radikaale, rakkude vaheline superoksiidi dismutaas muudab selle vesinikperoksiidiks, kaitseks nende aktiivsete hapniku ühendite vastu ümbritseb bakter end katalaasiga. Paljud bakterid toodavad periplasmasse aktiivset katalaasi, et kaitsta end peroksiidse kahjustuse eest. Sellisel juhul organismi bakterivastane rünnak pöördub organismi enda rakkude vastu.
Kasutatud kirjandus
- Kasutatud kirjandus L. Botsford, J.G. Harman, Microbiol. Rev.,1992, Vol.56, No 1, Cyclic AMP in prokaryotes.
- T. Jin and M. Inouye, J.Mol. Biol., 1993, 232, 484-492, Ligand binding to the receptor domain regulates the ratio of kinase to phosphatase activities of the signaling domain of the hybrid E.coli transmembrane recaptor Taz1.
- P.J. Kennelly and M. Potts, J. Bac. 1996,Aug., 4759-4764, Fancy meeting you here! A fresh look at prokaryotic protein phosphorylation.
- M.J. Merrick and r.a. Edwards, Microbiol. Reviews, 1995, Dec., 604-622, Nitrogen control in bacteria.
- J.B. Stock, A.M. Stock, J.M. Mottonen, Nature, 1990, 29 March, Vol.344, Signal transduction in bacteria.
- A.M. Stock and S.L. Mowbray, Cur. Op. Struc. Biol., 1995, 5, 744-751. Bacterial chemotaxis: a field in montion.
- M.A.Strauch, D.de Mendoza and J.A. Hoch, Mol.Microbiology,1992, 6, 2909-2917.
- Cis-unsaturated fatty acids specifically inhibit a signaltransduction protein kinase required for initiation of sporulation in Bacillus subtilis.
- Y. Yang, H.Park and M. Inouye, J.Mol. Biol., 1993, 232, 493-498, Ligand binding induces an asymmetrical transmembrane signal through a receptor dimer.