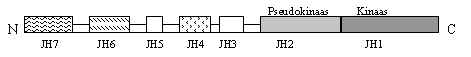
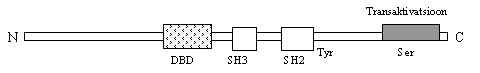
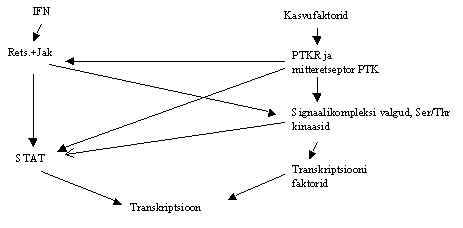
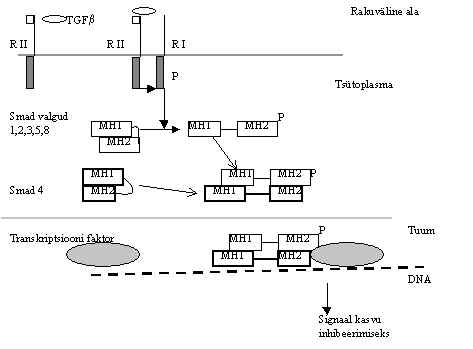
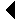Tuumor-nekroosi faktorit (TNF) toodavad peale makrofaagide ja monotsüütide ka paljud
teised rakud, sealhulgas T rakud, B rakud ja fibroblastid. TNF on 26-kDa suurune
transmembraanne faktor, millest proteaasidega lõigatakse 17-kDa lahustuv vorm. Mõlemad
vormid on aktiivsed trimeerina. TNF kuulub põletikuliste tsütokiinide hulka, tema
tootmine aktiveeritakse põletikuliste protsesside puhul. Oma nime on ta saanud sellest,
et tal on võime indutseerida kasvaja rakkude nekrootilist või apoptootilist surma. TNF
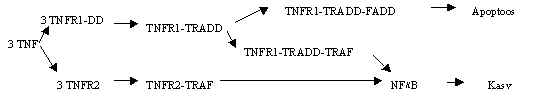
toimib kahe retseptori kaudu: TNFR1 ehk TNF-R55 ja TNFR2 ehk TNF-R75. Nende molekulmassid
on vastavalt 55 kDa ja 75 kDa. TNF-R55 seob faktorit affiinsusega 500 pM ja TNF-R75 seob
faktorit affiinsusega 100 pM. TNFR1 (p55) arvatakse olevat pidevalt madala tasemega
ekspresseeruv ja TNFR2 (p75) on paljude ärritajate poolt indutseeritav. Erinevad
retseptorid aktiveerivad erinevaid signaali teid. Faktori trimeeri seostumine kutsub esile
retseptori ahelate trimeriseerumise ja aktivatsiooni. TNFR1 omab tsütoplasmaatilises osas
nn. surma-ala DD (death domain). Üle mitmete abi-valkude (TRADD – TNFR associated
death domain, FADD – Fas receptor-associated death domain) võib selle retseptori
aktiveerimine viia rakud apoptoosi. Kui aga aktiveeritud retseptoriga seostuvad teised
faktorid (TRAF – TNF receptor-associated factor), siis stimuleeritakse rakkude kasv.
Teise retseptoriga TNFR2 seostuvad ainult need kasvu aktiveerivad faktorid ja see
retseptor ei aktiveeri apoptoosi teed. Nii et üks faktor võib stimuleerida rakkude kasvu
või surma, olenavalt retseptorist ja rakusisestest faktoritest. TNF-R1 ekspressiooni tase
on madalam ja tema affiinsus TNF suhtes on madalam, nii et see retseptor asub tööle, kui
TNF on raku ümbruses palju. Pildil 45 on kokku võetud TNF toimed.
Pilt 45. TNF retseptoritelt algavad signaalid.
Signaali teed, mida TNF aktiveerib, pole täpselt teada. Küll aga on teada, et TNF
toimel aktiveeritakse transkriptsiooni faktor NFk B ja selle
aktiveerimises on osalised oksüdeerijad. NFk B aktiveeritakse
rakus väga mitmete rakku kahjustavate ärritajate poolt, sealhulgas ka kiirguste poolt.
Selles aktivatsioonis võivad aktiivsed hapniku ühendid olla vahendajateks.
11. Oksüdatiivsed protsessid signaali
ülekandes.
11.1. UV kiirgus ja signaali teed rakus.
UV ja g -kiirgus indutseerivad mitmete valkude aktivatsiooni
või sünteesi, seal hulgas c-Fos, c-Jun, JunB, c-Myc, H-Ras, p53, Raf, c-Src, PKC, PTP,
IL-1, bFGF, TNFa , interferoon. Paljud neist on signaali ahela
komponendid. Millise mehhanismi kaudu signaali teed aktiveeritakse, pole teada. Arvamus,
et kiirguste märklaud rakus on ainult DNA ja selle mutatsioonid kutsuvad esile rakulise
vastuse, pole päris õige. Näiteks, on leitud, et UV signaali jõudmiseks
transkriptsiooni faktorile NFk B on vaja aktiveeritavat Src
kinaasi, Ras-valku ja Raf-valku. Kui mõni nendest rakus ei tööta, siis UV ei aktiveeri
NFk B. Selline aktivatsioon toimus ka ilma tuumata rakkudes,
mingit transkriptsiooni ei toimunud. Järelikult UV signaal võetakse vastu raku
välismembraanil, juhitakse edasi PTK-Ras-Raf-MAPK teele. Seega võib UV kiirgus
aktiveerida kasvufaktorite signaali tee. UV kiirguse toimet võivad takistada
antioksüdandid üsna tee algul, üleval pool Ras-valku. Väga võimalik, et kiirgus
toimib üle aktiivsete hapniku ühendite, tekitades hapniku radikaale, ja need
aktiveerivad biokeemilisi reaktsioone rakus. Kõigis rakkudes ei toimi UV üle Src-Ras-Raf
valkude. Kasvufaktorid ja UV aktiveerivad erinevaid MAP kinaase. UV poolt aktiveeritav
MAPK on JNK, kusjuures kõrgeima JNK aktivatsiooni kutsib esile lühilaineline UV (245
nm). Kiirgus ei ole ainuke hapniku radikaalide takitaja. Mitmete retseptorite
aktiveerimisel tõuseb lühiajaliselt superoksiidi radikaali ja vesinikperoksiidi tase
rakus. Makrofaagide aktiivsust hinnatakse just nende võime järgi toota superoksiidi
radikaali, viimane on siin antibakteriaalne agent raku välispinnal, aga ta võib
käivitada signaali tee ka raku sees. Viimastel aastatel on leitud, et superoksiidi
radikaalide tootmine ei ole omane mitte ainult makrofaagidele, vaid seda teevad ka teised
rakud mitmesuguste stimulaatorite toimel.
Eukariootne rakk toodab pidevalt reaktiivseid hapniku ühendeid. Mitokondrites
elektroni transport-ahelas tekib superoksiid radikaale; mõned ensüümide süsteemid
toodavad superoksiid-radikaale: ksantiin-oksidaas, NADH oksidaasid, aminohapete
oksidaasid, sealhulgas ka NOS. Hiljuti ilmus töö, kus näidatakse, et ilma superoksiidi
dismutaasi (SOD) juuresolekuta NOS reaktsiooni produkti NO ei ole võimalik detekteerida,
sest ta reageerib kiiresti tekkiva superoksiidi radikaaliga. Radikaalide taset
reguleeritakse rakus mitmete antioksüdantsete ensüümidega nagu SOD, katalaas,
peroksidaas. Nende tase muutub rakus olenevalt kasvu faasist. Peale nende on veel madala
molekulaarsed ühendid, mis muudavad raku redoks-olekut: glutatioon, askorbiinhape,
E-vitamiin jt. Superoksiidi tootmise ja tema taset reguleerivate süsteemide olmasolu
rakus viitab sellele, et sellised aktiivsed ühendid võiksid olla oaslised signaali
ülekande protsessis.
Oksüdeerijatele ja redutseerijatele on tundlikud nii AP-1 (Fos, Jun) kui NFk B rühma transkriptsiooni faktorid. In vitro tingimustes
on mõlema rühma faktorite seostumine vastavale DNA-le oksüdeerijate juuresolekul
takistatud ja redutseerijad taastavad seostumise. Raku tasemel oksüdeerijad aktiveerivad
NFk B, kuid AP-1 aktivatsioonile mõjuvad vähe või isegi
pärsivad seda. Samal ajal oksüdeerijad tõstavad oluliselt selliste AP-1 rühma
faktorite nagu Fos ja Jun mRNA taset, sama teevad ka mitmed antioksidandid. Nende geenide
promootorites on redoks-regulaator piirkonnad. Fos ja Jun valgu süntees tõuseb, aga Fos
ja Jun valgu monomeerid ei moodusta oksüdeerijate juuresolekul aktiivseid komplekse ja
seetõttu AP-1 aktivatsiooni ei toimu.

11.2. Transkriptsiooni faktor NFk B.
NFk B oli esimene eukariootne transkriptsiooni faktor,
mille regulatsioon näidati olevat seotud rakkude redoks-olekuga. NFk
B on raku tsütoplasmas inaktiivses vormis. Aktiveerijate toimel liigub ta tuuma ja
seostub vastava DNA järjestusega. NFk B on aktiivses vormis
dimeer, kas homo- või heterodimeer. Subühikuteks on 65 kDa valgud (p65) ja 50-52 kDa
valgud (p50, p52). Nii suuremaid kui väiksemaid subühikuid on teada mitmeid, ka ühes
rakus võib ekspresseeruda mitu Rel perekonna valku (p65 subühik) ja mitu väikse
subühiku valku. NFk B subühikud on kokkuvõetud pildil 46.
Erinevatest subühikutest võib moodustuda palju erinevaid dimeere, mis seostuvad DNA
järjestusele GGACTTTCCT või selle variatsioonidele. Oluliseimad on
allajoonitud nukleotiidid GGA ja TCC. See, millise affiinsusega iga dimeer DNA-le seob,
sõltub ka sidumiskoha lähemast ümbrusest. Seega erinevad dimeerid toimivad sageli
erinevatele promootoritele. Mõned dimeerid võivad olla transkriptsiooni blokeerijad.
Näiteks, ainult väikestest subühikutest koosnevad dimeerid ei oma transaktivatsiooni
võimet. Kas aktiveeritud NFk B, s.t. DNA-ga
seostumisvõimeline faktor, on mingile promootorile aktivaator või supressor, sõltub ka
teistest transkriptsiooni kompleksi kuuluvatest valkudest. NFk
B sidumise kohad võivad osaliselt kattuda teiste faktorite sidumikohtadega.
Pilt 46. NFk B ja Ik B
valgud, nende geenid ja sidumiskohad DNA-l.
Suured subühikud: Rel (c-Rel) rel, v-Rel v-rel, Rel
A (p65) rela, Rel B relb
Väiksed subühikud: p50 (p105) nfkb1, p52 (p100) nfkb2
Inaktiivsed vormid: p50-p65-Ik B, p105,
p100
Aktiivsed vormid: p65-p65, p65-50/52, p50-p50, p52-p52
Inhibiitorid: Ik B-a
ikba, Ik B-b , Ik B-g (p105 C-ots) nfkb1
Aktivaatorid: Bcl-3 bcl-3
Aktiivseid vorme siduv DNA : GGGACTTTCC, GGATTTCC,
GGGAAATTCC
Pilt 47. NFk B valkude topoloogia võrdlus.
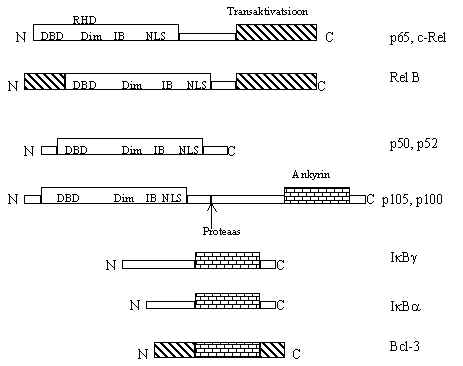
Pildil 47 on NFk B valkude topoloogia. On Rel-perekonna
valgud e. suured subühikud ja väiksed subühikud. Transkriptsiooni aktiveerivat
piirkonda omavad suured subühikud, kõigile on aga ühine nn. Rel-homoloogia ala (RHD).
RHD sisaldab DNA äratundvat piirkonda (DBD), subühikute dimeriseerumiseks vajalikku ala
(Dim), inhibiitor-valku siduvat ala (IB) ja tuuma lokalisatsiooni signaali (NLS). Nii et
RHD tagab subühikute dimeriseerumise, tuuma mineku ja DNA-ga sidumise. Väiksed
subühikud sünteesitakse suurte eellastena (p100, p105). Nad sisaldavad oma C-otsas
sellist järjestust (ankyrin), mis seob RHD, varjestab NLS ja ei lase valgul tuuma minna.
Ankyrini järjestust sisaldavad ka teised NFk B
inhibiitor-valgud Ik B-a ja b . See ala seostub spetsiifiliselt RHD-ga. Inhibiitori sidumine
varjestab NLS ja DBD, valk ei lähe tuuma ega seo DNA-ga.
Ka transaktivatsiooni domääni mitte omavad p52/50 homodimeerid on mõnedele
promootoritele aktivaatorid, nad võivad toimida koos teiste aktivaatoritega. On teada
vähemalt üks valk, mis seostub p52 homodimeeriga ja muudab selle transkriptsiooni
aktivaatoriks, see valk on Bcl3. Bcl-3 valk omab nii ankyriini kui ka transaktivatsiooni
domääni (Pilt 47). Ta seostub tuumas p52 homodimeeridega, kompleks jääb seotuks DNA-le
ja muutub transkriptsiooni aktiveerijaks. Bcl-3 seob ka p50 homodimeere, kuid see
põhjustab p50-p50-DNA kompleksi lagunemise, kuna p50-p50 dimeer on transkriptsiooni
inhibiitor, siis selle lahkumine DNA-lt aktiveerib transkriptsiooni. Nii et võib
aktivaator olla Bcl-3 mitmel viisil.
Pilt 48. NFk B aktivatsioon rakus.
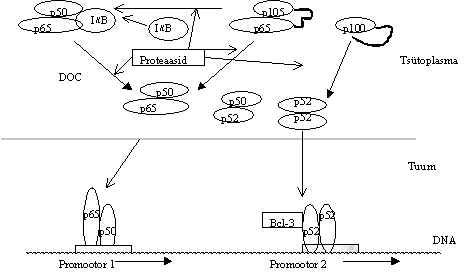
Pildil 48 on skeem NFk B aktivatsioonist. Valk p65 on
tsütoplasmas seotud inhibiitor-valguga Ik B, mida on ka mitu
erinevat valku (Ik Ba , Ik Bb ). Inhibiitor-valguga seotult faktor
tuuma ei lähe ja on inaktiivses vormis. p50 ja p52 on tsütoplasmas eellasvalguna p104 ja
p100, need eellased sisaldavad inhibiitor-järjestust, mis varjestab ära tuuma transpordi
signaali. Eellasvalgud tuuma ei lähe, nad võivad hoida tsütoplasmas ka p65, p65-p104
dimeerina. p50 ja p52 võivad olla tsütoplasmas ka p65-ga seotud ja seega moodustada
inaktiivse kompleksi p50-p65-Ik B. Ik
B ja p65 vahelist sidet võivad lõhkuda ka mõned detergendid (näit. Na-deoksükolaat e.
DOC). p100-st ja p104-st tekib tuuma minev valk ainult proteaaside toimel (pilt 47, 48).
Proteaasid lõhuvad ka p65-Ik B sideme degradeerides
inhibiitori. Aktivatsiooniks ongi inhibiitor-valgu lagundamine, see vabastab subühikud ja
laseb neil tuuma minna. Tuumas võib DNA siduv dimeer seostuda vastavale DNA alale mõnes
promootoris (P) ja aktiveerida transkriptsiooni. Transaktivatsiooni ala mitte omav dimeer
võib selle saada ühinedes näiteks Bcl-3-ga. NFk B
aktivatsioon toimub ilma uut valgu sünteesi käivitamata. Näiteks UV aktiveerib NFk B ka tsütoplastides, ilma tuuma osaluseta. Eespool oli näide
sellest, et UV aktiveerib NFk B üle Ras- Raf-valkude. Kuid NFk B aktivatsiooniks on ilmselt ka teisi mehhanisme, mõnedes rakkudes
on saadud NFk B aktivatsioon ilma Ras-Raf -valkudeta. NFk B aktivatsiooni mehhanismi uurimine on koondunud suures osas Ik B degradatsiooni uurimisele. Pildil 49 on Ik
B valk oma spetiiifiliste aladega.
Pitl 49. Inhibiitor k B-a
valk.
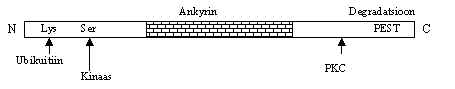
Inimese Ik B-a on 317
aminohappeline inhibiitor-valk. Degradeerimiseks on vaja N-otsas fosforüleerida Ser
jäägid. Näiteks, inimese Ik Ba
valgus Ser32 ja Ser36 on olulised, kui need on asendatud, ei toimu edasist
modifitseerimist ega degradeerimist. Kuid sellest üksi ei piisa, on vaja, et oleksid
paigas aminohapped ubikuitiini külge panemiseks, inimese Ik Ba valgus lüsiinid positsioonis 21 ja 22 ubikuintinüleeritakse e -aminorühmast ja tekkiv ubikuitiini polümeer viib valgu 26S
proteasoomi. Peale selle peavad olema aktiveeritud proteaasid. N-otsa fosforüleerimiseks
on suur 700 kDa valgukompleks. Ik Ba
valgu ankyrini-alast C-otsa poole jäävad PKC fosforüleerimise kohad ja degradatsiooni
signaal PEST, mis on rikas Pro, Glu, Ser ja Thr sisalduse poolest. Mitmed antioksüdandid
takistavad degradatsiooni ja oksüdeerijad stimuleerivad seda. Kuidas oksüdeerijad
toimivad, kas märgistavad veel kuidagi lõhutava valgu või aktiveerivad proteaase, pole
selge. On andmeid, et selles protsessis osaleb rasvhapete, just arahhidoonhappe,
metabolism. Millised metaboliidid vajalikud on, pole teada. Kuid arahhidoonhappe
oksüdatsiooni ensüümid lipoksügenaas, tsüklooksügenaas ja fosfolipaas A2
on mitmes rakuliinis vajalikud NFk B aktivatsiooniks. Viimasel
aja koguneb andmeid selle kohta, et lipiidsed peroksiidid on vajalikud NFk B aktiveerimiseks. Need ühendid tekivad ensümaatiliselt
lipoksügenaaside ja tsüklooksügenaaside toimel kulgevate reaktsioonide
vaheproduktidena, aga ka keemilisel teel oksüdeerijate, sealhulgas vesinikperoksiidi,
toimel. See seletaks fakti, et oksüdeerijad aktiveerivad NFk B
ainult raku tasemel aga mitte in vitro rakuekstraktis.
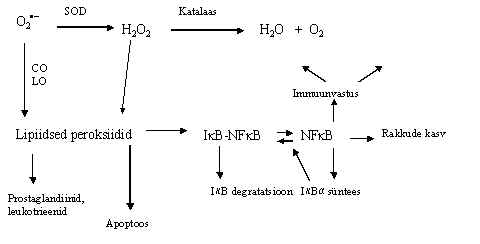
Pildil 50 on oletatav skeem NFk B aktivatsioonist
peroksiididega. Superoksiid-radikalid rakus kõrvaldatakse superoksiidi dismutaasi (SOD)
ja katalaasi abil. Superoksiidi radikaali kasutavad substraadina ka oksügenaasid,
oksüdeerides rasvhappeid viivad nad radikaali vesifaasist lipiidsesse faasi.
Lipoksügenaasid ja tsüklooksügenaasid toodavad rasvhapetest leukotrieene ja
prostaglandiine, kusjuures vaheproduktideks on väga aktiivsed lipiidsed peroksiidid.
Viimased tekivad ka keemilisel teel vesinikperoksiidi toimel. Lipiidsed perokiidid võivad
osaleda mõnede proteaaside aktiveerimisel, seega käivatada NFk
B inhibiitori degradatsiooni ja/või apoptoosi. Kui NFk B
regulatsioon käib a -inhibiitoriga, siis on aktivatsioon
lühiajaline, NFk B aktiveerib Ia
sünteesi ja see nihutab tasakaalu tsütoplasmas oleva kompleksi poole. NFk B aktivatsioon ei saa olla pikaajaline normaalses rakus. Ilmselt
piisab lühiajalisest NFk B aktivatsioonist rakulise
immuunvastuse käivitamiseks.
Pilt 50. Peroksiidid ja NFk B regulatsioon.
NFk B aktiveeritakse mitmesuguste ärritajate poolt. Tabelis
4 on tingimused, mille juures aktiveeritakse NFk B. See faktor
aktiveeritakse igasuguste rakku sissetungijate poolt: bakterid ja nende
lipopolüsahhariidid või toksiinid, viirused ja nende mõned valgud, eukariootsed
parasiidid, põletikulised tsütokiinid, kiirgused, oksüdatiivne stress. Praktiliselt
kõik rakku kahjustavad faktorid aktiveerivad NFk B. See on
raku häire süsteem, mis käivitab rakulise vastuse, mobiliseerib kõik jõud kahjustuse
kõrvaldamiseks.
Tabelis 5 on geenid, mida NFk B aktiveerib. Esimesena leiti
selline regulatsiooni ala immuunoglobuliini k ahela geeni
promootoris, sellest sai see transkriptsiooni faktor nime k B.
Hiljem on leitud NFk B sidumise koht paljude geenide
regulaatoralades: immunoretseptorid, tsütokiinid, adhesiooni molekulid, Ik Ba , NFk B
eellasvalk p105. Mõned viiruste promootorid sisaldavad ka NFk
B sidumise kohta.
NFk B aktiveerib paljusid promootoreid, sealhulgas soodustab
ta selliste faktorite tootmist, mis teda ennast aktiveerivad. Nn. põletikulised
tsütokiinid viiakse rakust välja ja nad toimivad naaberrakkudele, aktiveerides seal NFk B. Nii käivitatakse paljudes rakkudes rakuline vastus mingile
sissetungijale või ärritajale. NFk B aktivatsiooni
seostatakse sageli ka apoptoosiga. Nende kahe protsessi indutseerimisel osalevad sageli
ühised signaali rajad, kuid omavaheline seos pole selge. Viimaste aastate jooksul on
ilmunud mitu tööd, kus näidatakse, et apoptoosi lähevad rakud siis, kui NFk B inhibeeritakse. Sealjuures peab NFk B
enne aktiivne olema. Need rakud, kus NFk B ei ole aktiivne, ei
ole tundlikud ka tema inhibeerimisele. Ka see võib olla raku kaitse mehhanism: kui kõik
võimalused sissetungija kõrvaldamiseks on kasutusel, aga sellest ei piisa, siis
suunatakse rakk apoptoosi.
Tabel 4. NFk B aktivaatorid.
| Klass |
Aktivaator |
| Bakteriaalsed produktid |
Lipopolüsahhariidid, Eksotoksiin B jt. |
| Viirused |
HIV-1, |
|
Hepatiit B viirus (HBV) |
|
Inimese T-rakulise leukeemia viirus HTLV-1. |
|
Herpese viirused (HSV-1, HV6) |
|
Epstein-Barr’i viirus (EBV) |
|
Adenoviirus jt. |
| Viiruselised produktid |
Kaksikahelaline RNA |
|
HTLV-1 valk Tax, HBV valk X |
|
EBV valgud EBNA, LMP |
|
BPV E5 |
| Eukariootsed parasiidid |
Theileria parva |
| Põletikulised tsütokiinid |
Tuumor-nekroosi faktor a ,
Lümfotoksiin, Interleukiinid -1 ja 2, Leukotrieen B4 |
| T rakkude mitogeenid |
Anti-CD3,-CD2,-CD28 jt. |
| B rakkude mitogeenid |
Anti IgM |
| Fibroblastide mitogeenid |
Seerum |
| Valgu sünteesi inhibiitorid |
Tsükloheksimiid, Anisomütsiin |
| Füüsikalised tegurid |
UV ja g - kiirgused |
| Oksüdeerijad |
Vesinikperoksiid |
|
Butüülperoksiid |
| Mitmesugused kemikaalid |
Okada hape (okadaic acid) |
|
Forboolestrid |
Tabel 5. NFk B aktiveerib paljusid geene.
| Klass |
Geen |
| Immuunoretseptorid |
Immuunoglobuliini k kerge ahel |
|
T rakkude retseptori b ahel |
|
T rakkude retseptori a ahel |
|
Mitmed koesobivuse kompleksi osad |
| Raku adhesiooni molekulid |
Endoteliaalne leukotsüütide adhesiooni molekul (ELAM-1) |
|
Vaskulaar-rakkude adhesiooni molekul (VCAM-1) |
|
Rakkude vaheline raku adhesiooni molekul (ICAM-1) |
| Tsütokiinid ja vereloome rakkude kasvufaktorid |
b -Interferoon, GM-CSF, G-CSF ,
M-CSF, Interleukiinid 2,6,8 |
|
TNFa |
|
Lümfotoksiin (TNFb ) |
| Akuutse faasi valgud |
Angiotensinogen |
|
Seerum amülöid A eellane |
|
Komplement faktorid B ja C4 |
|
Urokinaasi tüüpi plasminogeeni aktivaator |
| Transkriptsiooni faktorid |
c-Rel, NFk B eellane p105 |
|
Ik B-a |
|
c-myc |
|
Interferooni regulaator-valk |
| Mitmesugused geenid |
Vimentiin |
|
NO-süntaas |
|
|
NFk B on üks oksüdeerijate poolt aktiveeritud faktor, kuid
mitte ainuke signaali ahela lüli, kus on olulised oksüdatsiooni/reduktsiooni protsessid.
Kui signaali ülekanne algab retseptori ahelate dimeriseerumisega, kus tsüsteiinid
moodustavad S-S-sildasid, siis on see SH-rühma oksüdeerumine. Tsüsteiinid oma
oksüdeeruvate SH-rühmadega on olulised nii Ras- kui Raf-valgu aktiveerimisel ja
transkriptsiooni faktorite DNA-ga seostumisel.

Kasutatud kirjandus
1. TIBS, 1992, Vol.17, No 10. Signal transduction: crosstalk
2. Cur. Op. Neurobiology, 1992, Vol.2, No 3. Signalling mechanisms
3. Trends in Genetics, 1991, Vol. 7, No 11/12. Signal transduction
4. Cur.Op. Neurobiology, 1993, Vol.3, No 3, Signalling mechanisms
5 Cur.Op. Neurobiology, 1994, Vol.4, No 3, Signalling mechanisms
12. Bourne et al., Nature 1991, 349,117-127. The GTPase superfamily.
13. E.J. Brown and S.L. Schreiber, Cell 1996, Vol.86,517-520. A signaling pathway to
translational control.
14. P.Chardin et al., FEBS Letters 1995,369, 47-51. The Grb2 adaptor.
15. J.E. Darnell Jr., Science,1997,277,1630-1635. STATs and gene regulation.
16. N. Divecha, Nature 1998, 394,13 August. Marked for nuclear export.
17.E.J. Goldsmith and M.H. Cobb, Cur. Op. Struc. Biology, 1994, Vol. 4, p. 833 - 840.
Protein kinases.
18. T. Erpel and S.A. Courtneidge, Cur.Op.Cell Biology 1995, 7, 176-182. Src family
protein tyrosine kinases and cellular signal transduction pathways
19. H. Hsu et al., Cell 1996, 84, 299-308. TRADD-TRAF2 and TRADD-FADD
interactions define two distinct TNFR 1 signal transduction pathways,.
20. J.N. Ihle et al., TIBS, 1994, Vol.19, May. Signaling by the cytokine receptor
superfamily: JAKs and STATs.
21. L.D. Kerr and S. Diego, Cur.Op.Cell Biology, 1992, Vol. 4, No 3, 496-501. Signal
transduction: the nuclear target.
22. T. Kishimoto, S.Akira, T. Taga, Science, 1992, 23 Oct., Vol.258. Interleukin-6 and
its receptor: a paradigm for cytokines
23. D.C. Liebler et al., Mol.Carcinogenesis, 1998, 22, 209-220. Reactive Oxidants from
NO,…..
24. C.J. Lovenstein, S.H. Snyder, Cell, 1992, 4 Sept., Vol.70. Nitric oxide, a novel
biologic messenger.
25. D.J. Mangelsdorf et al., Cell 1995, Vol. 83, 835-839. The nucler receptor
superfamily
26. J.Massegue et al., Trends in cell biology, 1997, 7, 187-191. TGF-b signalling through the Smad pathway.
27. M.G. Myers, X.J. Sun and M.F. White, TIBS, 1994, Vol. 19, July, 289-293. IRS-1
signaling system.
28. U. Siebenlist, G. Franzoso and K. Brown, Annu.Rev.Cell Biol 1994, 10, 405-455.
Stucture, regulation and function of NFk B.
29. G. Superti-Furga and S.A. Courtneidge, BioEssays 1995,17, 321-330.
Structure-function relationship in Src family and related protein tyrosine kinases,.
30. C.S. Reiss and T. Komatsu, J.Virology 1998, 72, 4547-4551. Does NO play a critical
role in viral infections?
31. L.Van Aelst and C.D’Souza-Schorey, Genes & Development 1997, 11,2295-2322.
Rho GTPases and signaling networks.
32. S. Watanabe and K. Arai, Cur.Op.Genet.& Dev. 1996, 6, 5587-596. Roles of the
JAK-STAT system in signal transductio via cytokine receptors.
33. Weiss and C.S. Tailor, Cell, 1995, 82, 531-533. Retrovirus receptors.
34. M. Whitman, Genes & development, 1998, 12, 2445-2462. Smads and early
developmental signaling by the TGFb superfamily.