7. Kasvufaktorite retseptoritelt algav signaali tee
7.1. Retseptor-proteiin-türosiinkinaasid
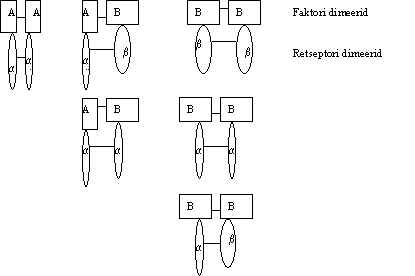
Kasvufaktoreid siduvad retseptorid on üks kord membraani läbivad polüpeptiidid ja paljudel on tsütoplasmaatilises osas türosiin-kinaasne aktiivsus; need viimased on retseptor-proteiin-türosiin-kinaasid (rPTK) ehk proteiin-türosiin-kinaassed retseptorid (PTKR). Aktivatsiooni käigus retseptori ahelad dimeriseeruvad ja fosforüleerivad teineteist. See tõstab nende kinaasset aktiivsust. Türosiin-kinaas on siin esimene aktiveeritav ensüüm. Aktiveeritud türosiin-kinaas fosforüleerib türosiine kas retseptori ahelas või mõnes teises valgus. Fosforüleeritud türosiin on oluline signaali edastaja. Retseptori ehitust ja aktivatsiooni vaatame konkreetsete näidete abil. Pildil 28 on skeem PDGF erinevate valkude ja tema retseptorite vahelistest kontaktidest. Ka teiste PTK retseptorite puhul on leitud, et on mitmeid retseptori valke, mis võivad anda homo- või heterodimeere, ja mis seovad faktoreid erineva affiinsusega.
Pilt 28. Trombotsüütidest pärit kasvufaktorite (PDGF) ja tema retseptorite dimeriseerumine.
PDGF - ekspresseeritakse kahte erinevat polüpeptiidi, A ja B ahel. Nad on kodeeritud erinevate geenide poolt ja ekspresseeruvad erinevalt olenevalt koe arengust ja spetsiifikast. Need ahelad moodustavad disulfiid-sildadega dimeere: AA, AB, BB. Erinevad faktori ahelad seostuvad erinevate retseptori subühikutega. Ka retseptori ahelaid sünteesitakse kahte tüüpi: a ja b . Retseptor, mis koosneb kahest ahelast, võib siis olla kas a a , a b või b b . Faktori ahel A seostub a -subühikuga ja B ahel seostub nii b -subühikuga kui ka a -subühikuga. Seega siis a a -retseptor seob nii AA, AB kui ka BB dimeeri, võib olla aktiveeritav kõigi kolme dimeeri poolt; a b -retseptor seob AB ja BB dimeere; b b -retseptor seob ainult BB dimeeri. Üldiselt PDGF A ahel ja retseptori a -subühik ekspresseeruvad varases arengu staadiumis, on olulised embriogeneesis. PDGF B ahel ja b -subühik osalevad patogeensetes protsessides. PDGF B-ahel ja b -subühiku süntees aktiveeritakse vigastatud koes. Näiteks, kopsus aktiveerub 6 tundi peale vigastust PDGFRb ekspressioon ja 12 tunni pärast algab PDGF B ahela süntees. Nende tase jääb kõrgeks kuni vigastus on parandatud, kui on kasvanud asemele uus kude. Toodud näites PDGFRb ekspressioon langes 5 päeva pärast ja B ahela süntees langes 9 päeva pärast. Krooniliste protsesside puhul, kus ei toimu kiiret paranemist, jääb see tase pikaks ajaks kõrgeks, vigastatud kude toodab pikka aega PDGF B ahelat ja see võib viia rakkude kontrollimatule kasvule. Näiteks, suitsetajatel ärritavad tahma osakesed pidevalt kopsu, indutseerides retseptori ja faktori kõrgenenud taseme, mis soodustab rakkude transformatsiooni. PDGF B ahel aktiveeritakse sageli ka teiste kasvufaktorite poolt, PDGF ja tema retseptor võivad vahendada teiste faktorite toimet.
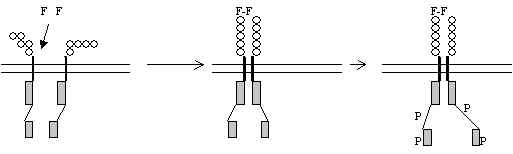
Pildil 29 on skeem retseptori ahelate dimeriseerumisest, kui faktor seostub ekstratsellulaarse osa külge.
Pilt 29. CSF retseptori aktiveerimine.
CSF - kolooniaid stimuleeriv faktor, homodimeerne glükoproteiin, tema retseptor CSF1R on proto-onkogeeni c-fms produkt; tema ekstra-tsellulaarses alas on 5 Ig-taolist ala ja raku sees on kinaasne domään, milles on insert; selles inserdis on fosforüleeritavad türosiinid. Kui ligandi dimeer seostub ekstra-tsellulaarsele alale, siis retseptori ahelad lähenevad teineteisele, dimeriseeruvad. Seda ahelate liikumist on mõnel juhul tõestatud ja selleks liikumiseks on oluline membraani sisene ala: kui seal on mutatsioonid, siis dimeriseerumist ei toimu ja aktiveerimist ka mitte, või vastupidi, saadakse konstitutiivselt aktiivne retseptor. Näiteks, roti EGFR transmembraanses alas Val 664 asendamine Glu-ga põhjustab konstitutiivselt aktiivse retseptori saamise - see on siis neu-onkogeeni produkt. Arvatakse, et transmembraanne ala ongi oluline dimeriseerumiseks. Insuliini retseptor on juba algselt dimeer, tema transmembraanne ala ei ole nii tundlik mutatsioonidele kui aktivatsiooni käigus dimeriseeruvate retseptorite transmembraanne ala. Kui retseptor on dimeriseerunud siis ahelad fosforüleerivad teineteist kinaassest alast ja see tõstab kinaasset aktiivsust, fosforüleeritakse türosiine ka mujalt, kas retseptori enda ahelas või ka mõnel substraadil. Näiteks, insuliini retseptor on rPTK, mis fosforüleerib IRS-valku (insuliini retseptori substraate: IRS-1 e. p185, või IRS-2, p190), signaali edastamises olulised fosfotürosiinid (P-Y) tekitatakse IRS külge. PDGFR ja EGFR puhul aga moodustuvad P-Y rühmad retseptori enda külge. Signaali edasi andmisel on oluline fosfotürosiin (P-Y). Fosfotürosiiniga seostuvad valgud, mis omavad nn. SH2-domääni (Src-valgu homaloogia 2). See on 100 aminohappeline järjestus, mis seob P-Y. SH2-domääni sisaldavad valgud võtavad signaali vastu fosfotürosiinilt. SH2-ala sisaldavad mitmed raku valgud: tsütoplasmaatilised proteiin-türosiin-kinaasid, mõned proteiin-fosfataasid, fosfolipaasid, fosfatidüül-inositool-3-kinaas, GTP-aasi aktiveerivad valgud, tsütoskeleti valgud ja nn. adapter-valgud. Viimased on väiksed valgud, mis ei oma mingit ensümaatilist aktiivsust, sisaldavad mitmeid valk-valk interaktsioone võimaldavaid piirkondi, paljud sisaldavad peale SH2-ala ka veel SH3-ala (ka see nimetus tuleb c-src geeni produktist), SH3-ala seostub spetsiifiliselt proliini rikka alaga valgus.
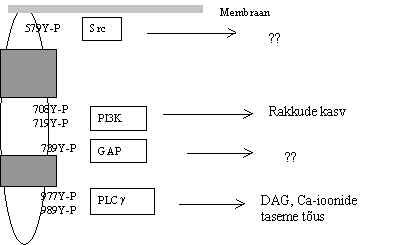
Iga SH2-valk seostub oma spetsiifilise P-Y piirkonnaga. Pildil 30 on PDGF b -retseptori tsütoplasmaatilises alas olevad kinaasi aktiivsuse ala (2 tumadat ristkülikut), fosforüleeritavad türosiinid ja sinna seostuvad valgud. PDGFR ahelas on mitu erinevat P-Y piirkonda, kuhu võivad seostuda mitmesugused SH2-valgud. Fosfatidüül-inositool-3-kinaas (PI3K) seostub kinaasses alas olevas inserdis, mitteretseptor türosiinkinaas (Src) seostub membraani lähedase alaga. GTP-aasi aktiveeriv valk (GAP) võib ka seostuda. PLCg alaliik omab PDGFR-s sidumise kohta. Nii võib ühelt aktiveeritud retseptorilt alguse saada mitu signaali teed, kui need vajalikud türosiinid on kõik fosforüleeritud. Ühe retseptori ahela külge võivad seostuda mitmed valgud, mis satuvad nii üksteise lähedale ja membraani lähedale.
Pilt 30. PDGF b -retseptori interaktsioonid järgmiste signaali ahela valkudega.
Fosfatidüül-inositool-3-kinaas (PI3K) on üks fosfotürosiiniga seostuja. Tema sidumise koht on paljudes retseptorites, ealhulgas ka PDGF b -retseptoris (Pilt 30). PI3K koosneb kahest subühikust: katalüütiline subühik p110 ja adapter-subühik p85. Viimane sisaldab: 1) kahte SH2-ala, nii et võib seostuda peale retseptori P-Y veel mõne teise valgu P-Y-ga; 2) ühte SH3-ala, see lubab tal seostuda ka mõne valgu proliini rikka piirkonnaga; 3) bcr-ala (break point cluster region), see osaleb mõnede GTP-aasidega seostumises. PI3K adapter e. regulaator-subühikuid on teada viis: p85a , p85b , p55a , p50a , p55PIK. PI3K adapter-subühik või teised adapter-valgud oma mitmete sidumise võimetega osalevad signaali transduktsiooni kompleksi moodustumisel.
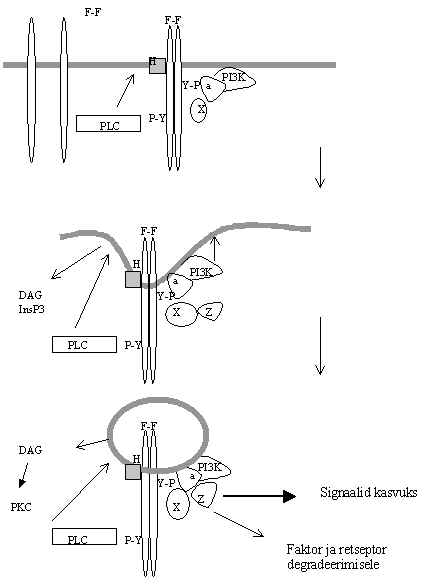
Pilt 31. Signaali transduktsiooni kompleksi tekkimine ja rakku transportimine.
Pildi 31 on oletatav skeem signaalitransduktsiooni kompleksi tekkimisest ja rakku tulemisest. Faktori dimeer (F-F) seostub retseptorile ja põhjustab retseptori dimeriseerumise ja aktiveerumise. Tsütoplasmaatilisse ossa moodustuvad fosfotürosiinid (Y-P), mis seovad kindlaid valke (PI3K, PLC). PI3K sattudes retseptoriga sidumise läbi membraani lähedusse, katalüüsib membraanis olevate fosfolipiidide fosfatidüül-inositool-4,5-bisfosfaadi ja fosfatidüül-inositool-4-fosfaadi fosforüleerimist inositooli 3. positsioonis. Nende fosforüleeritud produktide tõusu on täheldatud rakkudes, mida stimuleeritakse PDGF-ga või transformeeritakse polüoomi viirusega. On leitud ka vastav fosfataas, mis võtab ära inositooli rõngast 3. positsioonist fosfaadi, see on ka SH2 ala sisaldav valk ja võib kuuluda signaali transduktsiooni kompleksi. Selliste ühendite kiire tekkimine ja kadumine viitab nende võimalikule osalemisele signaali kandmises. Kinaasi seostumine retseptori ahela P-Y-le viib kinaasi membraanis olevate substraatide lähedale, kusjuures tõuseb ka tema aktiivsus. Kui aga membraanis suureneb polaarsete fosfolipiidide hulk, võib see aidata kaasa membraani liikumisele, sopistumisele, vesiikuli tekkimisele. PI3K seostataksegi sellega, et ta soodustab retseptori kompleksi rakku transportimist. PI3K omab homoloogiat pärmi (S.cerevisae) valguga VPS34, mis on oluline pärmis vakuoolide tekkimisel. Veel on leitud, et retseptori mutandid, mis ei seo PI3K, degradeeritakse aeglaselt ja kehvasti, nagu PTK aktiivsuse kaotanud mutantsed retseptoridgi. PI3K võib osaleda retseptori juurde moodustunud signaali transduktsiooni kompleksi rakku sisse transportimisel ja degradeerimisele viimisel. PI3K adapter-subühik (a) sisaldab mitut erinevat sidumiskohta, sell kaudu võivad kompleksi tulla veel mõned valgud (pildil 31 valgud X, Z). Kui retseptoriga on seotud ka PLCg , siis see toodab PKC aktivatsiooniks vajalikke DAG ja IP3, ja signaal võib edasi minna ka PKC teel. PDGFR kompleksi võivad seostuda veel mitmed valgud. On näidatud prooton ATP-aasi membraani sisese subühiku seotust sinna. Järelikult võib kompleksis olla prooton-ATP-aas (Pildil 31 H-ga tähistatud). Prooton ATP-aas pumpab vesiniku ioone ühelt membraani poolelt teisele ja muudab pH vesiikulis. pH muutused toimuvad rakus retseptori stimuleerimisel ja on vajalikud valkude degradatsiooniks. Signaali transduktsiooni kompleksi kuuluvad ka fosfataasid, tsütoplasmaatilised PTK-id, GTP-aasid ja seriin/treoniin-kinaasid. See on suur valkude kompleks, kus valgud üksteist aktiveerivad ja mille kaudu jõuab signaal lõpuks transkriptsiooni faktoritele.
7.2. Tsütoplasmaatilised proteiin-türosiinkinaasid.
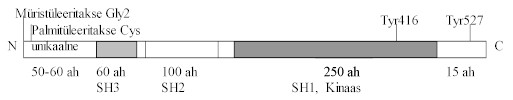
On ka sellised retseptorid, mis ise ei oma mingit ensümaatilist aktiivsust, kuid tõstavad türosiin-fosforüleeritud valkude hulka rakus. Selliste retseptorite aktiveerimisel moodustub mitmest peptiidist kompleks, mis aktiveerib raku siseseid proteiin-türosiin-kinaase. Paljud vereloome rakkude kasvu reguleerivad faktorid kasutavad seda teed ja nendes rakkudes ekspresseerub lai spekter tsütoplasmaatilisi proteiin-türosiin-kinaase. Tsütoplasmaatilised proteiin-türosiin-kinaasid e. mitteretseptor-proteiin-türosiinkinaasid kuuluvad ka signaali transduktsiooni kompleksi. Tsütoplasmaatilised PTK on membraan-seoselised kinaasid, mis omavad peale kinaasse ja regulaator-piirkonna veel SH2 ja SH3 domääne. Tuntumad on Src-perekonna kinaasid. Pildil 32 on selle perekonna kinaaside valgu skeem.
Pilt 32. Src-perekonna kinaaside topoloogia.
Valgu N-ots on modifitseeritav rasvhapetega, nende abil seostub kinaas membraaniga, edasi tuleb unikaalne ala, mille järgi saab selle perekonna üksikuid valke eristada. SH3 (umbes 60 aminohapet), SH2 (100 ah) ja kinaasne ala (SH1, 250 ah) on konserveerunud. Ka lühend SH tuleb nimest Src homoloogia, neid järjestusi on leitud paljudes valkudes. SH3 seob proliini-rikkaid piirkondi ja SH2 fosfotürosiini. C-otsas on regulaator-ala ja selles türosiin, mis fosforüleeritakse. Kui see on fosforüleeritud, siis kinaasi enda SH2 ala seostub selle fosfotürosiiniga ja ensüüm on inaktiivne, sest kinaasne tsenter on varjestatud. Aktiveerimiseks on vaja see türosiin defosforüleerida või SH2-ala siduda mõne teise valgu P-Y-ga, siis avaneb kinaasne domään. Teiseks P-Y sisaldavaks valguks võib olla aktiveeritud PTKR. Niiviisi saab retseptor PTK aktiveerida tsütoplasmaatilisi PTK. Näiteks, pildil 30 on näha aktiveeritud retseptoril sidumiskoht Src-kinaasidele. Mitte-retseptor e. tsütoplasmaatiliste PTK aktivatsiooni PTKR aktiveerumisel on näidanud ka mitmed eksperimendid. Src-kinaasi kinaasses alas oleva Tyr fosforüleerimine tõstab ensüümi aktiivsust.
7.3. Proteiin-türosiin-fosfataasid.
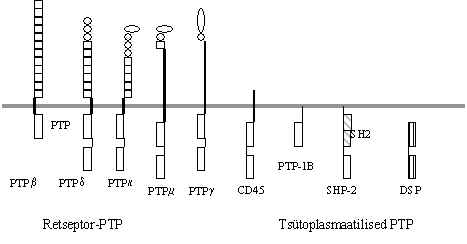
Kui mitte-retseptor-PTK aktiveerimine toimub regulaator-ala türosiini defosforüleerimise teel, on olulised proteiin-türosiin-fosfataasid (PTP). Neid on kirjeldatud just vereloome rakkudest. Üldiselt käib kineerimise ahelaga alati kaasas defosforüleerimine, s.t. fosfataasid ja kinaasid peavad mõlemad olema signaali ahelas aktiivsed. Fosfataasid tagavad selle, et kinaaside poolt aktiveeritud valgud on aktiivsed ainult lühikest aega. Kui fosfataasid inhibeerida, siis jääb signaal kauaks peale ja see võib viia raku kontrollimatule kasvule. Paljud fosfataaside inhibiitorid on tuntud kantserogeenid, s.o. kasvajaid tekitavad ühendid. Kuid mõned fosfataasid võivad olla ka signaali edastamisel aktiveerijad. On kirjeldatud transmembraanseid ja tsütoplasmaatilisi PTP, kokku umbes 75, konserveerunud katalüütiline ala hõlmab 240 am.h., sisaldab järjestust (I/V)HCxAGxxR(S/T)G. Pildil 33 on skeem mõnedest türosiinfosfataasidest.
Pilt 33. Transmembraansed ja tsütoplsmaatilised proteiin-türosiin-fosfataasid.
Transmembraansed PTPd omavad ühte membraani läbivat ala. Nad on retseptori sarnased valgud omades ekstratsellulaarses osas Ig-taolisi (ringid pildil) ja fibronektiini-taolisi piirkondi (ruudud) või mingeid teisi struktuure. Raku sees on üks või kaks fosfataasse aktiivsuse piirkonda. On teada vähemalt 10 loomset ja 4 Drosophila PTP. Nii inimesest, rotist kui ka hiirest on eraldatud PTP CD45 (on mitu isovormi erineva ekstratsellulaarse alaga), mis on vajalik T ja B rakkude aktivatsiooniks. See aktivatsioon arvatakse toimuvat just sellega, et nad defosforüleerivad mitte-retseptor PTK regulaator-alas P-Y ja avavad sellega kinaasse ala. Tsütoplasmaatilised PTP omavad ühte fosfataasse aktiivsuse ala ja teiste valkudega seostumise piirkondi (SH2, SH3 jt.). On teada 12 seda tüüpi PTP, tähistatakse ka SHP (SH-alaga fosfataasid). SH-PTP-2 seostub PDGF ja EGF retseptoriga ja võimendab signaali, võimalik, et defosforüleerides ja aktiveerides mitte-retseptor PTK. On kirjeldatud ka kahese spetsiifikaga proteiinfosfataase (DSP), need defosforüleerivad nii fosfotürosiini kui ka fosfotreoniini ja fosfoseriini.
7.4. Erinevad türosiinkinaasid ja signaali transduktsiooni kompleksi tekkimine.
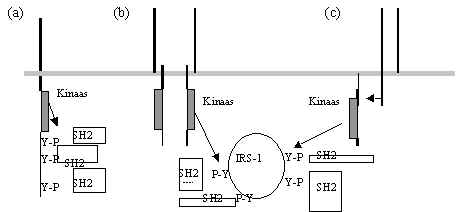
Pildil 34 on kokkuvõetud mitmesuguste türosiinkinaaside osa signaali kompleksi moodustamisel.
Pilt 34. Türosiinkinaasid ja võimalikud signaali vastu võtmise viisid.
a) Retseptor on PTK, aktiveerimisel retseptori ahelad (PDGFR, EGFR, CSF1R) fosforüleerivad teineteist ja SH2-valke siduvad fosfotürosiinid (P-Y) moodustuvad retseptori ahela külge. Valkude kompleks tekib retseptori külge ja retseptor tuuakse rakku (pilt 31).
b) Insuliini ja insuliini sarnaste kasvufaktorite retseptorite aktiveerimisel ahelad võivad teineteist ka fosforüleerida ja tõsta oma kinaasset aktiivsust, kuid ei valmista ette seostumise kohti retseptoril, vaid fosforüleerivad raku siseseid märklaudu, näiteks insuliini retseptori substraati (IRS) või adapter-valku Shc. IRS valgu N-ots vastutab insuliini retseptoriga kontakti eest. P-Y moodustuvad tsütoplasmaatilise valgu külge ja SH2-valgud seostuvad sellega, selle fosforüleeritud valgu ümber tekib signaali transduktsiooni kompleks. Retseptorit ei ole selles kompleksis. Retseptorit ei tuua rakku sisse, üks retseptor võib aidata kaasa mitme signaali transduktsiooni kompleksi tekkimisele.
c) Interleukiinide retseptorid, mis ei sisalda PTK aktiivsust, vajavad tsütoplasmaatilisi PTK, et fosforüleerida substraati (IRS või mõni teine valk) ja signaali edasi anda. IRS vahendab signaali paljudelt retseptoritelt, tema fosforüleeritus suureneb mitmete tsütokiinide toimel (IL-2,-4,-7,-9,-13,-15, LIF jt.). On leitud et IRS valgus seriini või treoniini fosforüleerimine alandab temas türosiini fosforüleerimist. Nii et seriin/treoniin-kinaasid moduleerivad ka türosiinkinaasidelt signaali edasi andmist.
Nüüd on vaadeldud mitut võimalust signaali vastu võtmiseks ja esmaseks edastamiseks SH2 ala sisaldavate valkude abil. Sageli osaleb signaali transduktsiooni kompleksi tekitamises spetsiaalseid adapter-valke. Need on väiksed valgud, mis omavad mitmesuguseid teiste valkudega seostumise kohti (SH2, SH3, bcr jt.). Selline valk on näitks ka PI3K adaptersubühik (a, pildil 31), mis võib siduda järgmisi signaali ahela lülisid. Üks enim uuritud adaptervalk on Grb 2 (growth factor receptor bound protein 2), mis võib osaleda retseptori P-Y ja mõne teise valgu vahelise kompleksi moodustamisel. Grb2 on leitud olevat kompleksis valguga mSOS. Viimane on Ras-valgu aktiveerija, aitab Ras-valgul vabaneda GDP-st. Aktiveeritud retsptoriga, tema fosfotürosiiniga, võib seostuda GTP-aasi aktiveeriv valk (GAP), selle sidumise koht on ka PDGF retseptoril (pilt 30). GAP ja mSOS valkude abil võib signaal minna edasi Ras-valgule.
7.5. Ras-valk
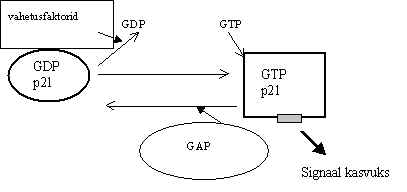
Nagu neurotransmitterite retseptorilt lähtuval signaali teel on osaline G-valk, nii on GTP-aasid signaali kandjad ka kasvufaktorite poolt aktiveeritaval teel. Erinevalt hetero-trimeersetest G-valkudest on need siin ühe subühikulised nn. väiksed G-valgud, M 21-23 kDa. Seda tüüpi väikseid G-valke osaleb mitmetes raku regulatsiooni protsessides, see on suur rühm erinevaid valke. Siin signaali tees on osalised Ras-perekonna GTP-aasid. Ras-valgu aktiveerimine on analoogne trimeerse G-valgu a -subühiku aktiveerimisega. Pildil 35 on Ras aktivatsiooni skeem.
Pilt 35. Ras-valgu aktivatsioon.
Signaali ahelas on valk inaktiivne kui seob GDP ja aktiivne, kui on seotud GTP-ga. Aktivatsiooniks on vaja asendada GDP GTP-ga, see on limiteeriv staadium, seda soodustavad guaniin-nukleotiidi dissotsiatsiooni stimulaatorid (GDS) e. guaniin-nukleotiidi vahetavad faktorid (GEF). Ras-valgu jaoks on üks vahetus-faktor mSos. Sos-valk leiti algul Drosophila süsteemis kui sevenless-retseptoriga seostuv valk ja sai sealt nime - son of sevenless. Nüüd on analoogne valk leitud ka loomsest rakust (mSos), sealhulgas ka inimesest. Ras-valk on väga nõrk GTP-aas. Ilma abivalguta ei suuda ta praktiliselt GTP hüdrolüüsida. On teada mitu GTP-aasi aktiveerivat valku, mis seostuvad Ras-valguga ja aktiveerivad tema GTP-aasset võimet. Üks selline on GAP, molekulkaaluga 120 kDa, omab kahte SH2 ja ühte SH3 ala, seega võib ka GAP seostuda fosfotürosiiniga ja kuuluda signaali transduktsiooni kompleksi. Ras-valgu aktiivsust reguleerivad temast 10-15 korda suuremad abivalgud: nukleotiidi vahetusfaktorid ja GTP-aasi aktivaatorid.
Ras-valk võib tulla ühelt poolt signaali transduktsiooni kompleksi GAP abil, mis tõstab tema GTP-aasset aktiivsust, GTP hüdrolüüsitakse ja Ras inaktiveerub. Teiselt poolt võib Ras seostuda mSos-valguga, see omakorda seostub Grb 2-ga ja Grb 2 seob aktiveeritud retseptori fosfotürosiiniga. mSos-valguga sidumine soodustab Ras-GDP muutumist Ras-GTP-ks, seega aktiivse vormi tõusu. Nii et Ras-valk võidakse signaali ülekande kompleksis nii aktiveerida kui ka inaktiveerida, olenevalt sellest milline tema abivalkudest on parajasti kompleksis aktiveeritud.
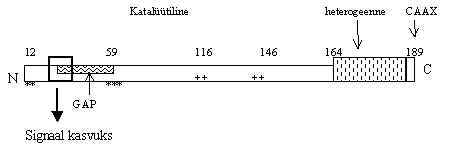
Pilt 36. Ras-valk p21ras.
Pildil 36 on Ras-valgu lineaarne skeem. Ras-valgu p21 katalüütiline domään on kõige konserveerunum läbi kõigi selle perekonna valkude. Temast N-otsa poole jääb efektor-ala, kuhu seostub GAP ja aktiveerib katalüütilise domääni. Selle piirkonna mutatsioonid (*) muudavad valgu GAP-tundetuks, s.t. GAP ei aktiveeri GTP-aasi ja Ras jääb pikaks ajaks aktiivsesse vormi. Teine rühm mutatsioone soodustavad GDP asendamist GTP-ga (+) ja suurendavad nii aktiivse vormi hulka. Kasvajatest eraldatud Ras-valgu geenid sisaldavad just neis alades mutatsioone. Ras on neis rakkudes pidevalt aktiivses vormis. GTP-ga seotud Ras-valgus toimub konformatsiooni muutus GAP sidumise koha lähedal (ruut pildil 36). See konformatsiooni muutus on vajalik signaali edasi andmiseks.
Katalüütilisest alast C-otsa poole on heterogeenne ala, mille aminohappeline järjestus on kõige varieeruvam Ras-perekonna valkudes. Päris C-otsas on CAAX motiiv, milles C on tsüsteiin, A on alifaatne aminohape ja X on sageli metioniini või seriini jääk, selline CAAX on märklaud farnesüül-transferaasidele. Kui aminohape X on leutsiin, siis on valk substraadiks geranüül-geranüül-transferaasile, sellised on Ras-valgu sugulased Rho ja Rac-valgud. Ras-valgud on suur perekond sarnaselt reguleeritavaid ja erinevais raku funktsioonides osalevaid valke.
Selleks, et Ras-valk oleks aktiivne, teeb ta läbi mitu modifikatsiooni CAAX-alas ja selle lähadal: 1)Cys farnesüleeritakse, s.t. pannakse külge pika ja hargneva ahelaga alkohol, milles on mõned kaksiksidemed kas cis- või trans-vormis; 2) kolm viimast aminohapet võetakse ära ja COOH-ots metüleeritakse; 3) heterogeenses alas palmitüleeritakse üks Cys. Kui CAAX-ala Cys ei ole isoprenüleeritud (farnesüleeritud), siis Ras-valk ei ole membraani küljes. Kui aga on farnesüleeritud, siis on 20% valgust membraanil, kui on farnesüleeritud ja C-ots on ära lõigatud, siis on 40% membraanil, ja kui vaba ots ka metüleeritud, siis on juba 60-80% valgust seotud membraanile. Farnesooli hargnev ahel ei lähe lipiidsesse kihti, ta hoiab valku küll membraani glükosüleeritud valkude küljes, aga sellest on vähe, et Ras-valk osaleks signaali ahelas. Ta peab seostuma membraani lipiidse kihiga, selleks palmitüleeritakse heteroloogses alas üks tsüsteiin. Isoprenüleeritult tuleb valk retseptori lähedusse membraanile ja seal ta palmitüleeritakse - siis on ta valmis funktsioneerima signaali ahelas. Kui modifitseerimata, s.t. membraaniga mitte seotud p21 eluiga on üle 24 tunni, siis membraan-seoselisel vormil on see ainult 20 minutit. Aktiivsed signaali ahela komponendid elavad lühikest aega. Kui on mutatsioonid, mis ei lase membraaniga siduda, siis on Ras-valk inaktiivne.
See, et Ras osaleb signaali ahelas peale PTK ja enne seriin/treoniin kinaase, on kindlaks tehtud antikehadega blokeerimise ja mutatsioonide abil. Ras võtab signaali vastu türosiin-kinaasidelt ja annab selle edasi seriin/treoniin-kinaasidele. Käivitatakse kaskaad, milles on mitu üksteisele järgnevat kinaasi ja lõpuks aktiveeritakse transkriptsiooni faktorid. Kinaaside kaskaadis on MAP kinaasid e. ERK, neid aktiveerivad MAP kinaasi kinaasid e.ERKK ja neid aktiveerivad MAP kinaasi kinaasi kinaasid e. ERKKK. Viimasesse rühma kuulub ka Raf-valk, mis võtab signaali vastu Ras-valgult.
7.6. Raf-valk
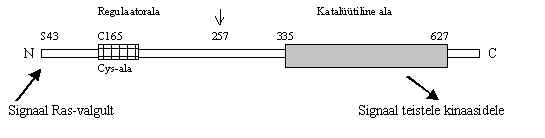
Pärmides annab Ras-valk signaali edasi adenülaat-tsüklaasile. Loomses rakus käivitatakse kinaaside kaskaad. Esimeseks selles ahelas arvatakse olevat Raf-kinaasid. Raf on proteiin-kinaaside perekond (M 67-94 kDa), mis fosforüleerivad seriini ja treoniini. Pildil 37 on valgu Raf-1 skeem.
Pilt 37. Raf-1 valk.
Raf-valgu molekul koosneb regulaator-alast ja katalüütilisest alast. Regulaator-ala inaktiveerib katalüütilise ala Raf-valgus ja mitte stimuleeritud rakkudes on katalüütiline ala ilmselt varjestatud. c-Raf-valgu N-terminaalse ala 1.- 257. aminohape on vajalikud kinaasse aktiivsuse inhibeerimiseks. Kui see ala proteaasidega ära lõigata (nool pildil 37), saadakse pidevalt aktiivne kinaas. Regulaator-alas on nn. Zn-finger motiiv, analoogselt PKC valgu regulaator-alale. Cys-rikas ala (C152, C155,C165, C168, H173, C176, C184) seal on oluline, selle puudumine või ka ainult C165 ja C168 muteerimine lõhub ära signaali vastu võtmise ja katalüütilise võime. Ras ja Raf seostumine toimub ka N-terminaalse otsa kaudu, kui seal fosforüleerida Ser 43 PKA-ga, siis Ras-Raf kontakt on takistatud (seda on näidatud in vitro ja vähemalt mõnedes rakkudes on see ka nii). Sellise mehhanismiga toimub cAMP mõju kasvufaktorite poolt aktiveeritud signaali teele. Fosforüleerimine ei toimi Raf-valgule igas kohas inaktiveerivalt, mõned kinaasid võivad Raf’i hoopis aktiveerida.
Raf kinaasne aktiivsus avaldub ka siis, kui Raf siduda mingite modifikatsioonide abil membraaniga, sel juhul ei ole Ras tema aktiveerimiseks vajalik. Järelikult, Ras aktiveerib Raf-valgu sellega, et viib ta kompleksi, kus on aktiveeritud PTK. Selles suures kompleksis on leitud olevat ka signaali ahela järgmised komponendid, kinaasid, mida Raf fosforüleerib. Need on MAP kinaasi kinaasid e. MEK-valgud.
7.7. MEK-valgud ja nende aktiveerimine
Raf aktiveerib kinaase üldise nimetusega MEK, s.o. MAP kinaasi / ERK’i kinaas. MEK’i võivad aktiveerida ka teised kinaasid, näiteks Mos, mis on ka üks seriin/treoniin-kinaas. MEK kinaase on peale Raf ja Mos veel, kasutatakse nimetusi MEKK 1-7. Nendest mõned on leitud olevat osalised apoptoosis. MEKK 1 on 196 kDa suurune valk, mis on proteaasiga caspaas-3 lõigatav ja aktiveeritav, kui rakke kiiritatakse UV-ga. MEK’i aktiveerivad mitmed kinaasid fosforüleerides temas seriini või treoniini. Kas kõik MEK aktiveerivad kinaasid on Ras poolt aktiveeritavad, pole teada. MEK-id on sellepoolest huvitavad kinaasid, et nad fosforüleerivad nii seriini/treoniini kui ka türosiini, kuna teised seni tuntud proteiin-kinaasid fosforüleerivad kas türosiini või seriini ja treoniini. Need kahese spetsiifikaga ensüümid ekspresseruvad kõigis rakkudes ja on vajalikud rakkude kasvuks ja diferentseerumiseks. Seni on 5 erinevat MEK valku kloneeritud. Uurituimad MEK-valgud on MEK 1 ja MEK 2. Nad on 43-46 kDa-lised valgud, mis fosforüleerivad MAP kinaasides (ERK 1 ja ERK 2) treoniini ja türosiini motiivis TPY. MEK 3 fosforüleerib p38MAPK Thr ja Tyr motiivis TGY. Erinevad MEK-valgud fosforüleerivad erinevaid substraate, leitakse juurde järjest uusi spetsiifilisi MEK-valke. MEK-1-s on mõned seriinid vajalikud negatiivseks regulatsiooniks, nende puudumine annab pidevalt aktiivse kinaasi. Nagu enamusel signaali ahelas osalevatel valkudel, on ka MEK-valgus olemas aktiveerimise ja inaktiveerimise alad. Konkreetseid MEK’e on seni vähe uuritud, kuid ilmselt on tegemist suure kinaaside perekonnaga.
7.8. MAP kinaasid.
MEK aktiveerib järgmisi kinaase, üldnimetusega MAP kinaas või ERK. MAP kinaaside nimetus tähendab mitogeen aktiveeritud proteiin kinaasid ja ERK tähendab ekstratsellulaarselt reguleeritud kinaasid. Neid nimetusi kasutatakse kirjanduses peaaegu paralleelselt, kuigi ERK on võib-olla laiema tähendusega kui MAP kinaas. Need on proliiniga suunatavad proteiin-seriin/treoniin-kinaasid, fosforüleerivad Pro järel olevat Ser või Thr, nende aktiivsust reguleeritakse treoniini ja türosiini fosforüleerimisega. Neid kinaase on ilmselt palju. Praeguseks on kirjeldatud 12 MAP kinaasi, mis jagunevad viide alarühma vastavalt funktsioonile ja ehitusele. Esimeses alarühmas on p44mapk ja p42mapk e. ERK 1 ja ERK 2 vastavalt. ERK 2 vajab Thr 183 ja Tyr 185 fosforüleerimist, et olla aktiivne. Need aktiveeritakse kasvufaktorite poolt. Teised MAP kinaasid on aktiveeritavad väga mitmesuguste signaalide poolt, peale kasvu ja differentsiooni faktorite võivad neid aktiveerida ka kiirgused jt. rakku kahjustavad tegurid. Eraldi alarühmas on Jun-valgu N-otsa kineerivad ensüümid JNK (kolm isovormi JNK1-3, 46-55 kDa-lised valgud), mis fosforüleerib ainult Jun-valgu Ser 63 ja Ser 73, aga mitte C-terminaalse ala seriine. JNK vajab aktivatsiooniks Tyr ja Thr fosforüleeritust. JNK nimetatakse sageli ka stress-aktiveeritud proteiinkinaasideks (SAPK), sest neid aktiveerivad mitmed rakku kahjustavad tegurid. JNK aktiveeritakse tugevalt UV kiirguse poolt. JNK aktiveeritakse fosforüleerimise teel MKK4 -ga, viimane omakorda aktiveeritakse MEKK1-ga. MEKK1 on aktiveeritav proteaasiga caspaas 3. JNK on inhibeeritud redoks-tundliku inhibiitori poolt. JNK fosforüleerib ja aktiveerib ka transkriptsiooni faktorit ATF2, mis kuulub CREB-ga ühte rühma. Nii et JNK substraadiks ei ole ainult Jun-valk. JNK võib aktiveerida transkriptsiooni paljudelt promootoritelt. MAP kinaasidest on UV kiirguse poolt aktiveeritavad ka p38MAP kinaasid.
MAP kinaasid fosforüleerivad paljusid valke, sealhulgas ka transkriptsiooni faktoreid. Nad aktiveerivad ja inaktiveerivad transkriptsiooni faktoreid. Näiteks, nii ERK1 kui ka ERK2 fosforüleerivad Jun-valgu C-otsa, alandades tema sidumist DNA-ga, JNK aga tõstab Jun-valgu transaktivatsiooni võimet. JNK aktivatsioon võib toimuda ka Ras-Raf teest sõltumata, selles võivad osaleda näiteks oksüdatsiooni /reduktsiooni protsessid. JNK aktivatsioon olevat vajalik apoptoosiks. Ka Fos valgu jaoks on spetsiifiline kinaas FRK, mis fosforüleerib Thr 232 Fos valgus ja on aktiveeritav Ras-ga. MAP kinaaside rühm järjest laieneb, leitakse uusi ja spetsiifilisemaid kinaase. Nad reageerivad erinevalt erinevatele stimulaatoritele.
7.9. Kokkuvõte kasvufaktorite retseptoritelt algavast signaali teest.
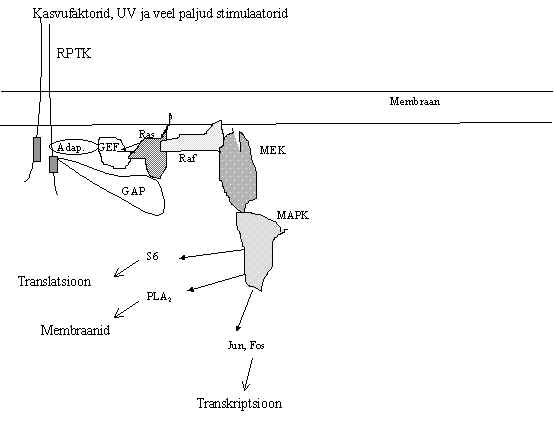
Pildil 38 on skeem kasvufaktorite retseptorilt algavast signaali teest. See on nn. klassikaline türosiin-kinaasidega algav signaali tee. Retseptori aktivatsioonile järgneb PTK aktivatsioon, aktiveeritakse kas retseptor või mitte-retseptor-kinaas. Fosforüleeritakse türosiin kas retseptori valgus või mõnes teises valgus. P-Y ja SH2 domäänide abil toimuvate valk-valk interaktsioonide kaudu hakkab tekkima signaali transduktsiooni komlpeks, kuhu seostuvad adaptervalkude (Ad) mitmete spetsiaalsete sidumisalade abil järgmised signaali ahelas osalevad valgud, Ras abivalgud GEF ja GAP. Nendega seostub Ras ja aktiveeritakse kas nukleotiidi vahetus GEF abil või GTP-aasne reaktsioon GAP abil. GTP-aas Ras muudab oma konformatsiooni ja kontakteerub teiste valkudega, toob signaali kompleksi uued kinaasid. Käivitatakse nn. kinaaside kaskaad, mille esimeseks lüliks on Raf, siis MEK ja MAP kinaasid. See kompleks liigub ilmselt membraanilt raku sisse ja samal ajal fosforüleerib mitmeid valke, näiteks ribosoomi valku S6, PLA2 , transkriptsiooni faktoreid. Sellega muutub nii valgu sünteesi, membraanide metabolismi ja paljude geenide aktiivsus.
Viimasel ajal kirjutatakse sellest, et Ras-valgu juurest hargneb peale kinaaside kaskaadi ka GTP-aaside kaskaad. See tähendab seda, et aktiveeritakse ka teisi GTP-aase peale Ras-valgu. Ras-valgu sugulased on GTP-aasid Rho/Rac perekonnast. Ka nende aktivatsiooni on leitud kasvufaktoritega rakke stimuleerides. Rho-valgud on GTP-aasid, mis osalevad raku tsütoskeleti muutustes. Rho-valgud aktiveerivad Ser/Thr kinaase ROK ja indutseerivad aktiini kiudude tekkimise rakus. Rac-valgud osalevad membraansete NAHPH oksidaaside aktivatsioonis, seega käivitavad nad superoksiidi radikaali tootmise. Peale selle aktiveerivad Rac-valgud mitmeid kinaase, nii türosiini kui seriini/treoniini kinaase ning lipiidide kinaase. Kokkuvõttes Rho- ja Rac-valkude aktivatsioon põhjustab raku morfoloogilisi muutusi. Ras-, Rho- ja Rac-valkude aktivatsioon on koordineeritud nende abivalkude abil. Sageli on Ras-valgu nukleotiidi vahetavad faktorid või GTP-aasi aktivaatorid võimelised seostuma ka Rho või Rac-valkudega või siis nende abivalkudega ja nii läheb signaal edasi.
Signaali ülekande kompleksi kuulub ilmselt veel valke, mis seda protsessi mõjutavad.
Pilt 38. Kasvufaktorite retseptorilt algav signaali tee.
Kuna sama tee aktiveeritakse nii rakkude kasvu kui diferentseerumist põhjustavate faktorite poolt, siis on üsna segane, miks on rakulised vastused nii erinevad. Ühe retseptori aktiveerimisel võivad tekkida erinevad signaali-ülekande kompleksid. Kõiki signaalitransduktsiooni kompleksi komponente on olemas mitmeid isovorme, nad avalduvad koe- ja arengu-spetsiifiliselt ning vastus sõltub sellest, millises arengu etapis on stimuleeritav rakk. Mõningate arvamuste järgi on oluline ka siinsete ensüümide aktivatsiooni kineetika, kui kaua on ükski signaali ahela lüli aktiivne. Kinaaside aktivatsiooniga käib kaasas ka fosfataaside aktivatsioon. Viimased defosforüleerivad kineeritud valke, tagades lühiajalise fosforüleerituse ja lühiajalise signaali ahela aktivatsiooni. Fosfataase on seni uuritud ehk vähem kui kinaase, kuid viimasel ajal ilmub üha rohkem töid spetsiifiliste proteiinfosfataaside kohta. Sarnaselt kinaasidele eristatakse ka fosfataase selle järgi millist aminohapet nad defosforüleerivad. PP, proteiin-fosfataas, märgib proteiin-seriin/treoniin-fosfataasi, need jagunevad mitmesse perekonda: PP1, PP2A, PP2B, PP5 - nad on aktiveeritavad ja inhibeeritavad erinevate ühendite poolt. PP1 ja PP2A on inhibeeritavad mõnede rasvhapete polüeetritega, näiteks okadahappega (okadaic acid). See C-38 rasvhappe polüeeter on tuntud kui kasvajaid tekitav ühend. Proteiinfosfataasid aktiveeritakse ka selliste modifikatsioonidega, mis seovad nad membraanidele. Kui näiteks blokeerida inhibiitoritega fosfataasi PP2A C-otsa metüleerimine, siis fosfataas ei tööta. PTP tähistab proteiin-türosiin-fosfataasi ja DSP kahese spetsiifilisusega fosfataasi, viimane defosforüleerib nii fosfotürosiini kui ka fosfoseriini/treoniini, olles seega MEK-ga kineeritud valkude defosforüleerijaks. Muidugi ei tööta ükski signaali tee isoleeritult, raku vastus välissignaalile sõltub kõigist rakus toimuvatest protsessidest. Kinaasid/fosfataasid ei ole ainsad ensüümid, mis reguleerivad signaali ülekannet, nagu eespool korduvalt mainitud on oluline signaali ahelas osalevate valkude modifitseerimine nii, et nad seostuksid membraanile, s.t. lipiidsed modifikatsioonid. Rasvhapete metaboliitidel on oluline osa signaali ülekandes, kuid neid protsesse on veel vähe uuritud.
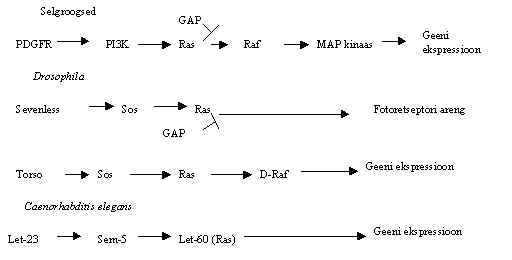
Kasvufaktorite retseptoritelt algava signaali tee komponedid on üsna konserveerunud läbi paljude organismide. Pildil 39 on kasvufaktorite retseptorilt algavad signaali teed erinevates organismides. Nii selgroogsetel, kärbsel kui ka nematoodil on leitud analoogseid signaali ülekande valke: TK-retseptorid, SH2-adaptervalgud, GTP-aasid, kinaasid. Valk-valk integratsioonidega kulgevat signaali ahelat on kirjaldatud selgroogsetel, nematoodil, Drosophilal.
Pilt 39. Proteiin-kinaasne signaali tee erinevates organismides.