4. cGMP osa signaali transduktsioonis.
Peale cAMP on signaali ülekandes osalemas veel teisigi tsüklilisi nukleotiide, eelkõige cGMP. cGMP tase on rakus madalam kui cAMP tase. cGMP osalus signaali vahendajana on tõestatud mõnedes kudedes: ajus glutamaadi NMDA-retseptori ärritumisel (s.o. Ca-kanalit moodustsv retseptor) tõuseb cGMP tase. cGMP osaleb veresoone seina silelihase rakus, soodustab lihase lõdvestumist, veresoone laienemist; osaleb soolte peristaltikas. cGMP on oluline haistmis-retseptori informatsiooni edastamisel neuronites, valgustundliku retseptori, rodopsiini, töös jm. cGMP aktiveerib proteiin-kinaasi G (PKG).
Kus tekib cGMP? Selleks on rakus guanülüül-tsüklaasid, mis katalüüsivad GTP muutumist cGMP-ks.
4.1. Guanülüül-tsüklaasid.
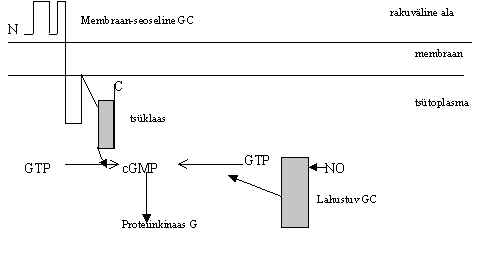
Pildil 14 on skeem cGMP tootjatest, guanülüül-tsüklaasidest e. guanülaat-tsüklaasidest. On leitud membraan-seoselisi ja lahustuvaid guanülüül-tsüklaase (GC). Membraanne GC on retseptori taoline valk, millel on ekstra-tsellulaarne osa, transmembraanne osa ja tsütoplasmaatiline osa; viimne kannab tsüklaasi aktiivsust. Lahustuv GC omab ainult katalüütilist funktsiooni, ta sisaldab heemi rühma. Heemiga seostub NO ja nitrosüleeritud GC on 50 korda aktiivsem cGMP tootja kui ilma NO-ta GC. Sama toimega on CO. Sellised mürgised gaasid nagu NO ja CO on GC aktiveerijad ja cGMP taseme tõstjad rakus. Suured NO ja CO kogused seostudes hemoglobiiniga takistavad verel hapniku rakkudesse kandmist ja on seega mürgid, kuid lokaalsed kontsentratsiooni muutused on signaali vahendajad. On leitud, et GC geen ekspresseerub nendes kudedes, kus NO süntetaas ja heemi oksügenaaski. Need ensüümid toodavad vastavalt NO või CO.
Pilt 14. Guanülüül-tsüklaasid
4.2. NO süntetaas.
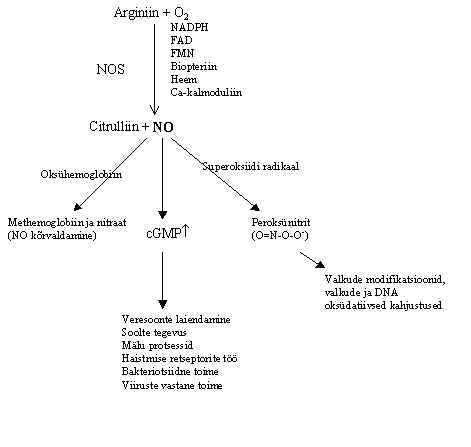
NO süntetaas ehk süntaas (NOS) on ensüüm, mis toodab rakus NO. Ta oksüdeerib arginiini guanidiini rühma, saadakse citrulliin ja NO:
Arginiin + O2 ® Citrulliin + NO
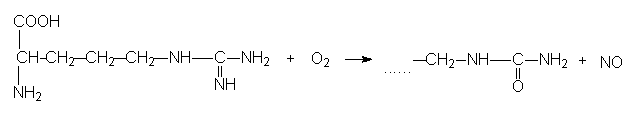
Seda ensüümi on leitud ja puhastatud ajust (nNOS), epiteeli rakkudest (eNOS) ja makrofaagist (iNOS), nad on eri geenide produktid, 50% aminohappeid on identsed.
Aju ja epiteeli rakust puhastatud vorm on konstitutiivselt ekspresseeruv NO süntetaas (subühiku M 125-160 kDa), mis aktiveeritakse Ca-ioonide poolt, kui retseptoriga seotud Ca-kanalid avanevad (pilt 15 a), Ca2+ taseme tõus 100 nM-lt 500 nM-ni tõstab NO tootmise 5%-lt 95%-ni. Hiljem on leitud, et Ca-aktiveeritavad eNOS ja nNOS ekspresseeruvad ka teistes rakkudes, mitte ainult epiteelis ja närvirakus, kust nad algselt saadi.
NO süntetaas on aktiivne dimeerina ja vajab mitut kofaktorit: riboflaviin mononukleotiidi (FMN), flaviin-adeniin-dinukleotiidi (FAD), nikotiinamiid-adeniin-dinukleotiid-fosfaati (NADPH), tetrahüdro-biopteriini, kalmoduliini, heemi. NOS on fosforüleeritav PKA, PKC ja Ca/kalmoduliin-kinaasi poolt, kuid selle mõju aktiivsusele pole selge. Flaviin-nukleotiide kofaktoritena kasutavad aminohapete oksidaasid annavad vaheproduktina superoksiid radikaale. Nii et NO süntaas on ka superoksiid radikaali tootja rakus. NOS on lokaliseeritud Ca-kanali lähedale, tema aktivatsioonis on oluline Ca2+, seda peetaksegi signaali kandjaks retseptorilt NOS-le. Ca2+ kontsentratsiooni tõusu järel aktiveerub NOS ja toodetakse NO, mis aktiveerib omakorda guanülüül-tsüklaasi, tõuseb cGMP tase. Samal ajal mõjuvad Ca-ioonid guanülüül-tsüklaasile inhibeerivalt, nii et aktiveerimine on ainult lühiajaline. NO inhibeerib NOS, kui seostub heemi rühmaga, NOS ei ole aktiivne kui NO tase on kõrge. NO eluiga on lühike - mõni sekund, kuid ta võib minna läbi raku membraani ja olla aktivaatoriks kõrvalraku GC-le. Seega on NO ka rakkude vaheline signaali vahendaja. Oluline on see haistmistsentris, kui tugevate lõhnade toimel aktiveeritakse suur Ca2+-ioonide kontsentratsiooni tõus, mis aktiveerib NOS ja inhibeerib GC, nii et samas rakus NO ei saagi GC aktiveerida, ta difundeerub teistesse rakkudesse ja aktiveerib seal GC. Sellisel teel toimub signaali võimendumine: ühe retseptori poolt vastu võetud signaalile vastavad mitu rakku.
Makrofaagides on indutseeritav NO süntetaas (iNOS), s.t. aktiveeritakse NOS geeni transkriptsioon ja NOS süntees (pilt 15 b), sellega võib seal NO tase pikemaks ajaks kõrgele tõusta. Peale makrofaagide on NOS induktsiooni leitud veel paljudes rakkudes: hepatotsüütides, fibroblastides, epiteeli ja lihase rakkudes. Indutseeritav NOS on Ca-sõltumatu, ei vaja aktivatsiooniks Ca-ioone. Induktsiooni täpne mehhanism pole teada, kuid see võib toimuda üle transkriptsiooni faktori NFk B.
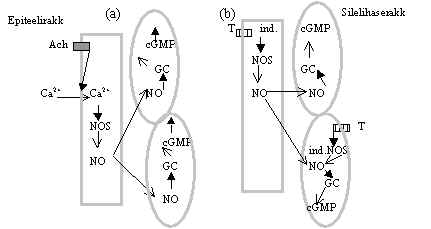
Pilt 15. Ca 2+ poolt aktiveeritav NOS ja indutseeritav NOS.
Pildil 15 (a) on Ca-ioonidega NOS aktiveerimine, mis võib toimuda epiteeli rakus. Tekkiv NO lähab kõrval olevasse lihase rakku ja aktiveerib seal GC, cGMP aktiveerib vastava kinaasi ja vastuseks on soole või soone seina relaksatsioon. On leitud, et sellise mehhanismi abil reguleerib bradikinin soole peristaltikat. Peale Ca-ioonidega aktiveerimise on NOS aktiivsuse tõusuks veel teinegi tee, see on pildil 15 (b). Mitmed toksiinid (T) võivad aktiveerida NOS transkriptsiooni, see on Ca2+sõltumatu NOS, Ca-ioone ei ole seal GC inhibeerimas ja aktivatsioon kestab kauem: epiteeli rakus toodetav NO läheb lihase rakku ja aktiveerib seal GC. Ka lihase rakus võib toimuda NOS induktsioon ja NO tootmine. Tõusnud cGMP tase aktiveerib PKG, see viib soole või soone seina lihaste lõtvumisele. Selline indutseeritav NOS toimib näiteks soole epiteelis, kus mõned toksiinid teda indutseerivad. Makrofaagide aktiveerumisel indutseeritakse neis NOS ja toodetavat NO kasutatakse bakterite vastase vahendina.
Pildil 16 on kokkuvõte NO toimetest. NO tõus molekulaarbioloogia huviorbiiti toimus 1990-ndatel aastatel, 1992 aastal oli NO valitud aasta molekuliks. NO on oluline paljudes organismi funktsioonides: 1) Veresoonte laiendaja, südame haiguste ravis on kasutusel NO doonorid. Näiteks, nitroglütseriin on pikka aega tuntud südame rohuna, organismis eraldab ta NO. Samal ajal on leitud, et NOS inhibiitorid on vererõhu tõstjad. 2) Mälu protsessides, NOS inhibiitorid takistavad õppimist. 3) Perifeersetes keha osades veresoonte laiendaja, sellega seostatakse tema osa seksuaalse signaali kandjana. Tuntud impotentsi ravim viagra tõstab NO taset organismis. 4) Bakteriotsiidne toime makrofaagides. 5) Rakkude vaheline signaali vahendaja.
Peale signaali ülekandes oluliste funktsioonide täitmise võib NO kui aktiivne keemiline ühend kahjustada paljusid raku valke ja muteerida DNA. Suures koguses NO seostub hemoglobiiniga ja hakkab takistama hapniku transporti. NOS on indutseeritud paljude autoimmuunsete haiguste puhul. On leitud, et NO inhibeerib paljude viiruste replikatsiooni. Rakkudele NO doonorite lisamine takistab mitmete viiruste ekspressiooni neis rakkudes (polioviirused, pikornaviirused CVB3 ja rhinoviirus, herpesviirused HSV-1 ja Epstein-Barr viirus). Kõik viirused ei ole blokeeritavad NO-ga (alfaviirus Sindbis viirus, gripi viirus A/WSN, ensefaliidi viirus). Mehhanismid, kuidas NO toimib viirustele, pole selged.
NO toime selgitajad said 1998 a.Nobeli preemia meditsiini alal. Need on USA teadlased Ferid Murad (Texase Ülikool), kes avastas 1977.a., et südamerohud, sh nitroglütseriin, eraldavad organismis NO. Robert F. Furchgott (New Yorgi tervise keskus), kes leidis 1980.a., et inimese rakud eritavad mingit veresooni laiendavat ainet. Louis J. Ignarro (Los Angelese California Ülikool), kes tõestas 1986.a., et veresooni laiendab organismis NO.
Pilt 16. NO saamine ja toimed.
4.3. CO signaali ülekandes.
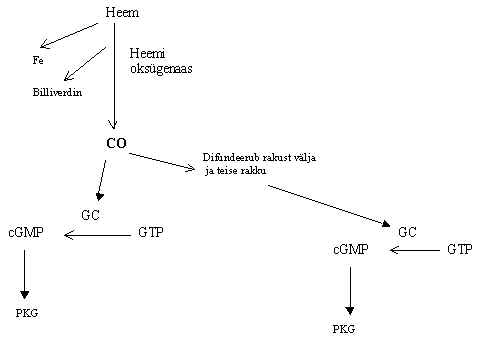
NO-ga sarnaselt toimib CO. Teda toodetakse heemi oksügenaasi poolt. Algselt leiti see ensüüm põrnas ja maksas, kus ta on heemi poolt indutseeritav ja lõhub heemi. Kuid nüüd on leitud ajus ja vähesel määral ka mujal mitteindutseeritav heemi oksügenaas-2, mis arvatakse olevat seal just selleks, et CO toota. Heemi oksügenaas-2 ekspresseerub seal, kus ei ole NOS ja ekspresseerub GC geen. Eriti kõrge on heemioksügenaasi ekspressiooni tase haistmisneuronites ja seal on CO osa GC aktiveerimises olulisem kui NO osa. Lõhnad tõstavad cGMP kontsentratsiooni haistmisneuronites ja kontsentratsiooni tõus ei ole inhibeeritav nitroarginiiniga, on aga blokeeritav hemoglobiiniga ja Zn-protoporfüriiniga, mis on heemioksügenaasi inhibiitor. See näitab, et mediaator on CO aga mitte NO. Mõlemat ühendit, nii NO kui CO, toodavad konstitutiivsed ja indutseeritavad ensüümid. Esimesed on ülekaalus ajus. Heemi oksügenaas-2 on leitud olevat ka veresoone seina silelihases, kus ta toodab CO ja see aktiveerib GC ka siis kui NOS on inhibeeritud. Kokkuvõte CO saamisest ja toimest on pildil 17.
Pilt 17. CO koht signaali ülekandes.
5. Ca2+ osa signaali ülekandes.
Paljude retseptorite stimuleerimisel muutub rakus Ca-ioonide tase. Ca-kanaleid on kirjeldatud mitmeid tüüpe ja nad on subühikulise ehitusega nagu retseptoridgi. Erinevate Ca kontsentratsioonide juures käivituvad erinevad kanalid ja erinevates raku tüüpides töötavad erinevad kanalid. Ca2+ on väga oluline signaali kandja rakus, Ca kontsentratsioon võib muutuda 10000 korda - 0,1mM kuni 1mM - ja seda millisekundite jooksul.
Ca-ioonide taset rakus reguleerivad mitmed mehhanismid
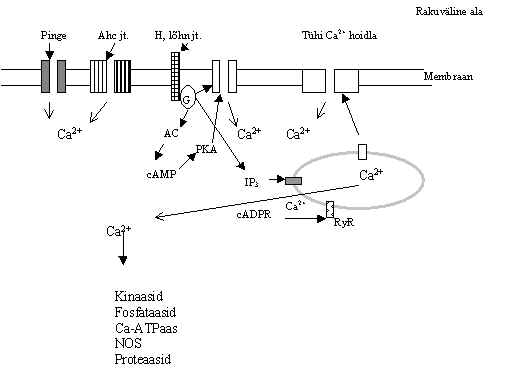
A. Rakuvälisest ruumist tuleb Ca2+ ioonkanalite vahendusel; on nelja tüüpi kanalid (pilt 18):
1) pinge-avatavad kanalid, ka neid on mitu tüüpi, erinevate pingetega avatavad, Ca kontsentratsioon tõuseb kiiresti, mõne millisekundi jooksul, kõrge Ca2+ kontsentratsioon suleb kanali;
2) retseptor-avatavad kanalid, ionotroopsed retseptorid ( nAch retseptor, glutamaadi retseptor, jt. katiooni kanalit moodustavad retseptorid), Ca kontsentratsioon tõuseb vähem kui 100 msek jooksul;
3) signaali vahendaja poolt avatavad kanalid, G-valguga seotud retseptori aktiveerimisel hormooniga (H) või lõhnaga tõuseb näiteks cAMP tase, see aktiveerib siis PKA ja see fosforüleerib ioonkanali regulaator ala. Aktiveerida võib ka muude modifitseerimistega, siin on retseptori stimuleerimise ja ioonide kontsentratsiooni tõusu vaheline aeg pikem, sekundid, minutid või isegi tunnid. G-valk võib kanali avada ka otsese kontakti teel, siis kulub selleks ainult 200 msekundit, üle cAMP ja PKA aga vähamalt 30 sek.
4) Ca-hoidlate tühjenemisega aktiveeritav kanal, seda tüüpi kanalite avamiseks on vaja enne kogu raku sisene Ca ära kasutada, et Ca-hoidlad oleksid tühjad, siis selles hoidlas on mingid signaal-valgud (E pildil 18), mis aktiveerivad kanali.
B. Raku sisestest hoidlatest Ca vabanemine (Pilt 18). Ca-ioonid vabanevad hoidlatest mõnede signaali vahendajate abil: 1) IP3 - inositool-1,4,5-trisfosfaat, selle kontsentratsiooni tõus rakus toimub mitmete retseptorite stimuleerimisel, ta seostub temale vastava retseptoriga Ca-hoidla pinnal ja sellega aktiveerib Ca vabanemise; IP3 abil Ca vabanemine hoidlatest toimub, kui Ca2+ kontsentratsioon on vahemikus 10-1000 nM, kui kontsentratsioon on üle 3000 nM, siis Ca vabanemist ei toimu. 2) cADPR - tsükliline adenosiin-difosfaat-riboos, teda toodetakse paljudes rakkudes NAD-st ADP-ribosüül tsüklaasi abil, ta vabastab Ca ryanodiini retseptori kaudu ja vajab aktivatsiooniks ka Ca olemasolu, see on Ca-indutseeritud Ca vabanemine. Ryanodiini retseptor (RyR) on ühele mürgile - ryanodiinile - tundlik Ca hoidla retseptor. Isektitsiid ryanodiin toimib mürgina tühjendades putuka rakus Ca-ioonide hoidlad ja rikkudes Ca-ioonide jaotuse.
Pilt 18. Ca2+ taseme regulatsioon rakus.
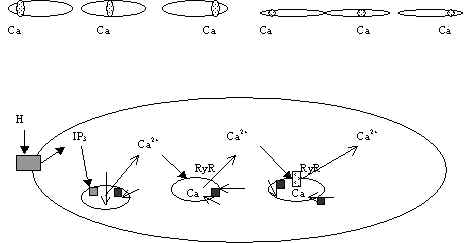
Ca taset saab rakus näha värviliste Ca-siduvate ühendite abil. Sellisel viisil on leitud, et Ca-ioonide kontsentratsioon raku sees kõigub väga suurtes piirides, on pildistatud nn. Ca-laineid: kõrge Ca-ioonide kontsentratsioon liigub mööda rakku. See näitab, et Ca lokaalsed kontsentratsioonid on väga erinevad rakus. Pildil 19 on näha Ca-lained ja selgitav skeem nende tekkimiseks. Südame lihase ja silelihase rakkudes on jälgitud värviliste ühenditega seotud Ca-ioonide kontentratsiooni muutusi. Tugevalt värvuvad kohad liiguvad mööda rakku. Südame lihase rakus liigub selline Ca-laine kiirusega kuni 150 m m sekundis ja silelihase rakus umbes 20 mm sekundis. Ca-ioonide kontsentratsiooni muutused on rakus lokaalsed. Kuidas sellised lained tekivad?
Pilt 19. Ca2+-lained.
Südame lihase rakus 150m m/sek silelihase rakus 20 mm/sek
Pildil 19 on skeem, mis püüab seletada Ca-lainete tekkimist. Retseptor aktiveeritakse (tume nool) hormooniga (H), G-valgu kaudu aktiveeritakse fosfolipaas C, selle toimel vabaneb IP3, mis vallandab oma retseptori (hall ruut) abil Ca-voo hoidlast, Ca difundeerub hoidlast eemale (hele nool), lähedal olevad Ca-ioonid viiakse Ca-pumpade (mustad ruudud, heledad nooled) abil hoidlasse tagasi kuna Ca2+ aktiveerib ka Ca-ATP-aasid, teise hoidlani jõudnud Ca aktiveerib seal Ca vabanemise ryanodiini retseptori ja cADPR abil jne. Ca-ioonide taseme tõusu registreeritakse vahetult peale tema vabanemist hoidlast, nii tekivad Ca-lained.
Kokkuvõtteks võib öelda, et Ca-ioonide kontsentratsiooni muutused on kiired, lokaalsed, lühiajalised; Ca-pumbad hoolitsevad selle eest, et Ca tase rakus ei jääks kõrgeks ja Ca ise inaktiveerib kanalid. Ca/kalmoduliin aktiveerib membraansed Ca-ATP-aasid, mis Ca tsütosoolist ära suunavad, ja aktiveerib fosfataasi PP-2B, mis defosforüleerib PKA poolt aktiveeritud Ca-kanali, kanal sulgub. Kui Ca-ioonide tase on tsütosoolis üle 3m M, siis on inhibeeritud Ca vabanemine rakusisestest hoidlatest IP3 retseptori abil.
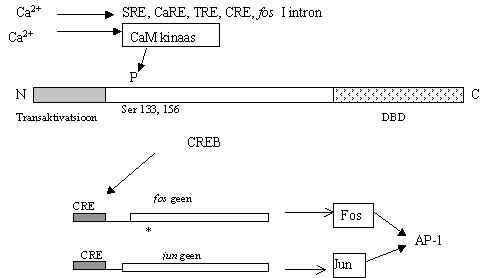
Pilt 20. Ca2+ mõjub transkriptsioonile.
Pildil 20 on skeem sellest, kuidas Ca võib mõjuda transkripsioonile. Ca toime jõuab välja CRE (cAMP respons-element), SRE (seerum-respons-element), CaRE ja TRE (Ca-respons-element ja TPA respons-element) järjestustele promootorites, fos geeni ekspressiooni kontrollib Ca ka 1. intronis oleva ala abil: kui Ca puudub, siis transkriptsioon katkeb seal ja Ca lisamine eemaldab selle blokeerimise.
Kuidas siis osaleb Ca signaali edastamises? Ca seostub kalmoduliiniga. Kalmoduliin on väike valk, 148 aminohapet, ta omab nelja Ca-sidumise ala. Kõrgeima affiinsusega on neist kolmas ja neljas, s.t. COOH-otsa poolsed. Ca2+ sidumist võib takistada Mg2+ seostudes Ca sidumise alale. Kalmoduliin/Ca seostub paljudele ensüümidele, kõigepealt nn. multifunktsionaalsetele kinaasidele, mida nimetatakse Ca2+/kalmoduliin-kinaasid (CaM kinaas). See on suur seriin/treoniin-proteiin-kinaaside perekond, 6-12 subühikulised (50-60kDa) valgud. N-terminaalne ala on katalüütiline, keskmine on regulatoorne ala, need on tugevalt konserveerunud nii imetajate, Drosophila kui ka pärmi rakkudes. Varieeruv COOH-ots vastutab subühikute liitumise eest, moodustab keskmise südame osa multimeersele ensüümile, mis on ümbritsetud globulaarsete katalüütiliste domäänidega, tekib lille õie taoline struktuur (6-12 kroonlehega).
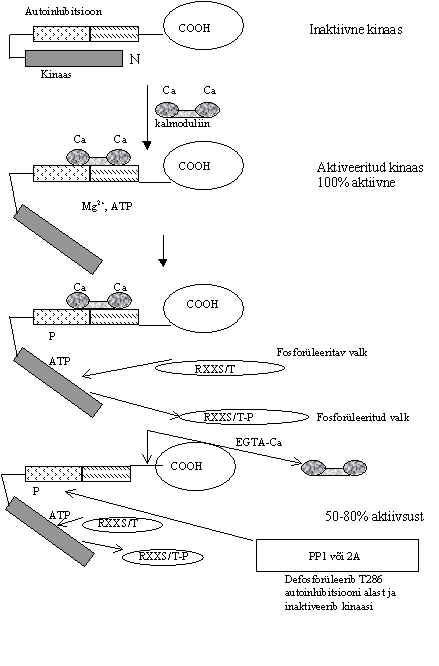
Pilt 21. Ca2+/kalmoduliinist sõltuva proteiinkinaasi II regulatsioon.
Pildil 21 on skeem Ca/kalmoduliiniga aktiveeritava proteiin-kinaasi (CaM-KII) aktivatsioonist. Ensüüm on inaktiivne, kui kinaasne ala N-otsas on seotud valgu keskel olava autoinhibitsiooni järjestusega (MHRQETVDCLKKFNAR). Selle kõrval on regulaator ala, kuhu seostub Ca/kalmoduliin. Ca/kalmoduliini sidumine regulaatoralale lõhub ära autoinhibitsiooni katalüütilises osas ja kinaas aktiveerub, fosforüleeritakse substraadi seriin või treoniin ja samal ajal fosforüleerib ensüüm ka ennast 6-7 kohast. Autofosforüleerimine treoniin 286 kohalt autoinhibitsiooni piirkonnas aktiveerib kinaasi nii, et see on aktiivne ka ilma Ca/kalmoduliinita. Saadakse Ca-sõltumatu kinaasi vorm, mille kinaasne aktiivsus on madalam kui Ca-ga aktiveeritud vormil. Aktiivne proteiinkinaas II inaktiveeritakse proteiinfosfataasiga 1 või 2A.
CaMKII esineb rakus lahustunud kujul ja membraaniga seotult. Substraatideks on mõnede retseptorite subühikud, nende fosforüleerimine muudab tundlikkust, CaMKII inaktiveerib NO süntetaasi, samal ajal Ca/kalmoduliin jälle aktiveerib seda ensüümi. Osa CamKII vorme on leitud ka tuumas, kus ta fosforüleerib CREB Ser 156 või 133 kohalt. Siin jõuab Ca signaali tee kokku cAMP vahendatud signaali teega.
Ca/kalmoduliinist sõltuvate kinaaside hulgas on ka kõrge spetsiifilisusega proteiinkinaase: müosiini kerge ahela kinaas, fosforülaasi kinaas, elongatsiooni faktori 2 kinaas. Need reguleerivad vastavalt lihase kontraktsiooni, glükogenolüüsi ja valgu sünteesi.
Ca/kalmoduliin seostub ka veel cAMP fosfodiesteraasile, plasma membraani Ca-ATP-aasile, NOS-le ja ilmselt veel teistelegi valkudele.
Ca ioon võib olla ka rakuväline signaali kandja. On kirjeldatud Ca retseptor, CaR. See on G-valguga seotud retseptor, mis reageerib Ca kontsentratsiooni muutustele rakuvälises ruumis. Seal on Ca2+ tase tavaliselt palju kõrgem kui raku sees.